Nhãn khoa
EYLEA - Dung dịch tiêm nội nhãn

Thành phần hoạt chất:
Một millilit dung dịch để tiêm trong dịch kính có chứa 40 mg aflibercept.
Mỗi lọ thuốc cung cấp một liều đơn 50 microlit có chứa 2 mg aflibercept.
Mỗi lọ chứa thể tích 278 microlit dung dịch tiêm trong dịch kính trong đó lấy ra được khoảng 100
microlit.
Thành phần tá dược:
Polysorbate 20
Natri dihydro phosphat, monohydrat (để điều chỉnh pH)
Dinatri hydro phosphat, heptahydrat (để điều chỉnh pH)
Natri chlorid
Sucrose
Nước pha tiêm
Dung dịch tiêm nội nhãn.
Dung dịch nước vô trùng, trong suốt, không màu đến vàng nhạt, đẳng trương, pH 6,2
EYLEA được chỉ định để điều trị
- thoái hóa hoàng điểm tuổi già có tân sinh mạch máu (thể ướt) (wet age-related macular degeneration –wet AMD)
- phù hoàng điểm thứ phát do tắc nghẽn tĩnh mạch võng mạc trung tâm (macular edema secondary to central retinal vein occlusion -CRVO)
- phù hoàng điểm thứ phát do tắc nghẽn nhánh tĩnh mạch võng mạc (macular edema secondary to branch retinal vein occlusion - BRVO)
- phù hoàng điểm do đái tháo đường (diabetic macular edema - DME)
- tân mạch hắc mạc do cận thị (myopic CNV - CNV cận thị)
EYLEA được dùng để tiêm trong dịch kính.
Chỉ các bác sỹ chuyên khoa được đào tạo và có kinh nghiệm tiêm thuốc trong dịch kính mới được sử dụng.
Chế độ liều
1. Thoái hóa hoàng điểm tuổi già có tân sinh mạch (thể ướt) (wet AMD)
Liều khuyến cáo của EYLEA là 2 mg aflibercept (tương đương với 50 microlit dung dịch tiêm).
Điều trị khởi đầu EYLEA với 1 mũi tiêm/ tháng trong 3 liều liên tiếp. Khoảng cách điều trị sau đó được mở rộng đến 2 tháng.
Khoảng cách điều trị có thể được duy trì mỗi 2 tháng hoặc dài hơn dựa trên đánh giá của bác sĩ về thị lực và/hoặc giải phẫu khi sử dụng chế độ liều điều trị và mở rộng (Treat and Extend: T&E), bằng cách mở rộng khoảng cách giữa các lần tiêm 2 hoặc 4 tuần trong khi vẫn duy trì kết quả thị lực và/hoặc giải phẫu ổn định. Nếu kết quả thị lực và/hoặc giải phẫu xấu hơn, khoảng cách điều trị nên được rút ngắn phù hợp nhưng tối thiểu là 2 tháng trong suốt 12 tháng điều trị đầu tiên.
Không cần giám sát giữa các lần tiêm. Dựa trên đánh giá bác sĩ có thể quyết định lịch trình thăm khám thường xuyên hơn so với lịch trình tiêm.
Khoảng cách điều trị dài hơn 4 tháng giữa các lần tiêm chưa được nghiên cứu (xem phần “Các đặc tính dược lực học”).
2. Phù hoàng điểm thứ phát do tắc nghẽn tĩnh mạch võng mạc trung tâm (CRVO)
Liều dùng cho EYLEA là 2 mg aflibercept (tương đương với 50 microlit dung dịch tiêm).
Sau khi tiêm liều ban đầu, điều trị thuốc hàng tháng cho đến khi có kết quả điều trị về thị lực và/hoặc giải phẫu ổn định. Có thể cần sử dụng ba mũi tiêm liên tiếp hàng tháng hoặc nhiều hơn. Khoảng cách giữa hai liều không nên ngắn hơn một tháng (4 tuần).
Điều trị cần duy trì tiếp tục và khoảng cách giữa hai liều có thể được kéo dài hơn dựa trên kết quả về thị lực và/hoặc giải phẫu (chế độ liều điều trị và mở rộng ).
Thông thường, việc giám sát cần được thực hiện ở các lần tiêm. Trong thời gian điều trị với khoảng cách giữa hai lần tiêm kéo dài hơn cho đến khi kết thúc điều trị, lịch giám sát nên được xác định bởi các bác sĩ điều trị dựa vào đáp ứng của từng bệnh nhân và có thể là thường xuyên hơn so với lịch trình tiêm.
3. Phù hoàng điểm thứ phát do tắc nghẽn nhánh tĩnh mạch võng mạc (BRVO)
Liều dùng khuyến cáo của EYLEA là 2 mg aflibercept (tương đương với 50 microlit dung dịch tiêm). Sau khi tiêm liều ban đầu, điều trị thuốc hàng tháng cho đến khi có kết quả điều trị về thị lực và/hoặc giải phẫu ổn định. Có thể cần sử dụng ba mũi tiêm liên tiếp hàng tháng hoặc nhiều hơn. Khoảng thời gian giữa hai liều không nên ngắn hơn một tháng (4 tuần).
Điều trị cần duy trì tiếp tục và khoảng cách giữa hai liều có thể được kéo dài hơn dựa trên kết quả về thị lực và/hoặc giải phẫu (chế độ liều điều trị và mở rộng ).
Thông thường, việc giám sát cần được thực hiện ở các lần tiêm. Trong thời gian điều trị với khoảng cách giữa hai lần tiêm kéo dài hơn cho đến khi kết thúc điều trị, lịch giám sát nên được xác định bởi các bác sĩ điều trị dựa vào đáp ứng của từng bệnh nhân và có thể là thường xuyên hơn so với lịch trình tiêm.
4. Phù hoàng điểm do đái tháo đường (DME)
Liều dùng khuyến cáo của EYLEA là 2 mg aflibercept (tương đương với 50 microlit dung dịch tiêm).
Điều trị khởi đầu EYLEA với 1 mũi tiêm/tháng trong năm liều liên tiếp, sau đó tiêm một mũi mỗi 2 tháng. Không cần giám sát giữa các mũi tiêm.
Sau 12 tháng đầu điều trị với EYLEA, dựa trên kết quả thị lực và/hoặc giải phẫu, khoảng cách điều trị có thể được mở rộng, như chế độ liều điều trị và mở rộng, bằng cách tăng dần khoảng cách điều trị trong khi vẫn duy trì kết quả thị lực và/hoặc giải phẫu ổn định; tuy nhiên chưa có đầy đủ dữ liệu để kết luận thời gian của những khoảng cách điều trị này. Nếu kết quả thị lực và/hoặc giải phẫu xấu hơn, khoảng cách điều trị nên được rút ngắn phù hợp.
Lịch trình thăm khám nên được quyết định bởi bác sĩ điều trị và có thể thường xuyên hơn so với lịch trình tiêm.
Không nên tiếp tục sử dụng EYLEA nếu kết quả thị lực và giải phẫu cho thấy không đem lại lợi ích cho bệnh nhân nếu tiếp tục điều trị.
5. Tân mạch hắc mạc do cận thị (CNVcận thị)
Liều khuyến cáo của EYLEA là 1 liều tiêm trong dịch kính 2 mg aflibercept (tương đương với 50 microliters dung dịch tiêm).
Có thể tiêm các liều bổ sung nếu các kết quả về thị lực và/hoặc giải phẫu cho thấy bệnh vẫn còn tồn tại. Tình trạng bệnh tái phát được điều trị như khi có bệnh mới mắc.
Lịch trình thăm khám nên được quyết định bởi bác sĩ điều trị.
Khoảng cách giữa hai liều không nên ngắn hơn 1 tháng
Thông tin bổ sung về các quần thể bệnh nhân đặc biệt
- Các bệnh nhân bị suy gan và/hoặc suy thận:
Chưa tiến hành các nghiên cứu riêng biệt về việc sử dụng EYLEA trên bệnh nhân bị suy gan và/hoặc suy thận.
Các dữ liệu hiện có không cho thấy cần phải hiệu chỉnh liều EYLEA trên các bệnh nhân này (xem phần Các đặc tính dược động học).
- Người cao tuổi:
Không cần thiết phải quan tâm đặc biệt.
- Trẻ em và trẻ vị thành niên:
Hiệu quả và an toàn của EYLEA chưa được nghiên cứu trên quần thể này.
Cách dùng
Tiêm trong dịch kính phải được thực hiện bởi các bác sỹ được đào tạo, có kinh nghiệm tiêm trong dịch kính, theo các tiêu chuẩn y tế và các hướng dẫn phù hợp. Nói chung, phải đảm bảo gây tê và vô khuẩn đầy đủ, bao gồm việc sử dụng các chất sát trùng phổ rộng tại chỗ (ví dụ bôi povidon iod vào vùng da quanh mắt, mí mắt và bề mặt nhãn cầu). Khuyến cáo sát trùng tay phẫu thuật, sử dụng găng vô khuẩn, vải che vô khuẩn và panh mi mắt vô khuẩn (hoặc dụng cụ tương đương).
Ngay sau khi tiêm trong dịch kính, cần giám sát bệnh nhân về tăng nhãn áp. Việc giám sát phù hợp có thể bao gồm kiểm tra tưới máu đầu dây thần kinh thị giác hoặc đo nhãn áp. Nếu cần thiết, nên có sẵn dụng cụ vô khuẩn để rạch nhãn cầu.
Sau khi tiêm trong dịch kính, cần hướng dẫn bệnh nhân báo cáo ngay bất kỳ triệu chứng nào gợi ý đến viêm mủ nội nhãn (ví dụ đau ở mắt, đỏ mắt, sợ ánh sáng, nhìn mờ).
Chỉ dùng mỗi bơm tiêm chứa dung dịch hoặc lọ thuốc để điều trị cho một mắt. Sau khi tiêm, phải bỏ đi các phần thuốc không dùng đến (còn lại).
- Nhiễm trùng mắt hoặc quanh mắt
- Tình trạng viêm nội nhãn nặng hoạt động
- Quá mẫn với aflibercept hoặc với bất kỳ tá dược nào của chế phẩm
Các phản ứng liên quan đến tiêm trong dịch kính
Tiêm trong dịch kính, bao gồm cả tiêm trong dịch kính với EYLEA, có liên quan đến viêm mủ nội nhãn, viêm nội nhãn, bong võng mạc do bị rách, rách võng mạc và tổn thương đục thủy tinh thể do bác sĩ (xem phần Tác dụng không mong muốn của thuốc), phải luôn sử dụng kỹ thuật tiêm vô khuẩn thích hợp khi sử dụng EYLEA. Ngoài ra, bệnh nhân cần được theo dõi trong tuần sau khi tiêm để cho phép điều trị sớm nếu xảy ra nhiễm trùng. Cần hướng dẫn bệnh nhân báo cáo ngay bất kỳ triệu chứng nào gợi ý đến viêm mủ nội nhãn và cần xử lý phù hợp.
Tăng áp lực nội nhãn đã được quan sát thấy trong vòng 60 phút sau khi tiêm trong dịch kính, bao gồm cả tiêm EYLEA (xem phần Tác dụng không mong muốn của thuốc). Cần lưu ý đặc biệt trên bệnh nhân bị glôcôm kiểm soát kém (không được tiêm EYLEA khi áp lực nội nhãn ≥ 30 mmHg). Do vậy, trong tất cả các trường hợp, phải giám sát cả nhãn áp và tình trạng tưới máu đầu dây thần kinh thị giác và có xử lý phù hợp.
Tính sinh miễn dịch
Vì là một protein trị liệu, EYLEA có khả năng gây sinh miễn dịch (xem phần Tác dụng không mong muốn của thuốc). Bệnh nhân cần được hướng dẫn để thông báo bất kỳ dấu hiệu hoặc triệu chứng nào của viêm nội nhãn, ví dụ như đau, sợ ánh sáng, hoặc đỏ mắt, là những dấu hiệu lâm sàng có thể do quá mẫn.
Tác dụng toàn thân
Các biến cố có hại toàn thân bao gồm xuất huyết ngoại nhãn và biến cố thuyên tắc huyết khối động mạch đã được báo cáo sau khi tiêm nội nhãn với chất ức chế VEGF và có nguy cơ về lý thuyết rằng điều này có thể liên quan đến sự ức chế VEGF. Dữ liệu về độ an toàn hiện còn hạn chế trong điều trị bệnh nhân CRVO, BRVO, DME hoặc CNV cận thị có tiền sử đột quị hoặc cơn thiếu máu thoáng qua hoặc nhồi máu cơ tim trong vòng 6 tháng gần đây. Cần thận trọng khi điều trị cho những bệnh nhân này.
Khác
Như các điều trị nội nhãn bằng kháng VEGF khác cho AMD, CRVO, BRVO, DME hoặc CNV cận thị, các thông tin sau đây cũng được áp dụng:
- Tính an toàn và hiệu quả của việc sử dụng EYLEA trong điều trị đồng thời cả hai mắt chưa được nghiên cứu một cách hệ thống (xem phần Các đặc tính dược lý). Việc điều trị cả hai bên mắt nếu được thực hiện cùng một thời điểm có thể dẫn đến tăng phơi nhiễm toàn thân, điều này có thể làm tăng nguy cơ của các biến cố có hại toàn thân.
- Sử dụng đồng thời với các thuốc kháng VEGF khác (vascular endothelial growth factor – yếu tố tăng trưởng nội mô mạch máu).
- Chưa có dữ liệu về việc sử dụng đồng thời EYLEAvới các sản phẩm y khoa kháng VEGF khác (toàn thân hoặc tại mắt).
- Các yếu tố nguy cơ liên quan đến sự phát triển của tình trạng rách biểu mô sắc tố võng mạc sau điều trị AMD thể ướt bằng kháng VEGF, bao gồm bong biểu mô sắc tố võng mạc diện rộng và/hoặc cao. Khi bắt đầu điều trị với EYLEA, cần thận trọng khi sử dụng ở những bệnh nhân có các yếu tố nguy cơ với rách biểu mô sắc tố võng mạc.
- Cần ngưng điều trị với những bệnh nhân bị bong võng mạc do rách hoặc hố hoàng điểm võng mạc giai đoạn 3 hoặc 4.
- Trong trường hợp rách võng mạc, cần ngưng thuốc và không được tiếp tục điều trị cho đến khi tổn thương được khôi phục đầy đủ.
- Cần ngưng thuốc và không được tiếp tục điều trị sớm hơn lịch điều trị kế tiếp trong trường hợp:
o giảm thị lực tốt nhất sau chỉnh kính (BCVA) ≥ 30 chữ cái so với lần đánh giá thị lực gần nhất;
o xuất huyết dưới võng mạc bao gồm hố trung tâm võng mạc, hoặc nếu kích thước vùng xuất huyết ≥50% của vùng tổn thương.
- Cần ngưng thuốc trong vòng trước hoặc sau 28 ngày trong trường hợp có kế hoạch hoặc thực hiện phẫu thuật nội nhãn.
- Không nên sử dụng EYLEA trong thai kỳ trừ phi lợi ích tiềm tàng vượt trên nguy cơ tiềm ẩn đối với thai nhi (xem phần Sử dụng thuốc cho phụ nữ có thai và cho con bú).
- Phụ nữ có khả năng mang thai cần sử dụng biện pháp tránh thai hiệu quả trong khi điều trị và trong ít nhất 3 tháng sau liều tiêm trong dịch kính cuối cùng của aflibercept (xem phần Sử dụng thuốc cho phụ nữ có thai và cho con bú).
- Kinh nghiệm hạn chế trong điều trị cho bệnh nhân CRVO và BRVO thiếu máu cục bộ. Không khuyến cáo điều trị ở những bệnh nhân xuất hiện các triệu chứng lâm sàng mất thị lực không hồi phục do thiếu máu cục bộ.
Quần thể với dữ liệu hạn chế
Kinh nghiệm còn hạn chế trong điều trị cho bệnh nhân DME do đái tháo đường type 1 hoặc ở bệnh nhân đái tháo đường có HbA1c lớn hơn 12% hoặc với bệnh lý võng mạc tăng sinh do đái tháo đường.
EYLEA chưa được nghiên cứu ở các bệnh nhân nhiễm trùng toàn thân thể hoạt động hoặc ở những bệnh nhân có đồng thời các bệnh lý về mắt khác ví dụ như bong võng mạc hoặc hố hoàng điểm. Không có kinh nghiệm điều trị với EYLEA ở bệnh nhân đái tháo đường có tăng huyết áp mất kiểm soát. Bác sĩ cần cân nhắc việc thiếu thông tin khi điều trị cho các bệnh nhân này.
Đối với CNV cận thị, không có kinh nghiệm từ các nghiên cứu lâm sàng trong việc sử dụng EYLEA để điều trị cho bệnh nhân không phải người châu Á, các bệnh nhân trước đó đã được điều trị CNV cận thị, và các bệnh nhân có tổn thương ngoài hố hoàng điểm.
Tương tác với các thuốc khác và các loại tương tác khác
Chưa có nghiên cứu chính thức về tương tác thuốc được tiến hành với EYLEA
Tương kỵ
Không được trộn EYLEA với thuốc khác
Phụ nữ có thai
Chưa có dữ liệu về sử dụng aflibercept trên phụ nữ có thai.
Các nghiên cứu trên động vật cho thấy thuốc có độc tính trên sinh sản sau khi dùng đường toàn thân (xem phần Dữ liệu an toàn tiền lâm sàng).
Không khuyến cáo sử dụng EYLEA trong thai kỳ trừ khi lợi ích vượt trội nguy cơ cho thai.
Phụ nữ có khả năng mang thai
Phụ nữ có khả năng mang thai cần sử dụng biện pháp tránh thai hiệu quả trong khi điều trị và trong ít
nhất 3 tháng sau liều tiêm trong dịch kính cuối cùng của EYLEA.
Phụ nữ cho con bú
Chưa biết aflibercept có được bài tiết qua sữa mẹ hay không. Không thể loại trừ nguy cơ cho trẻ bú mẹ.
Không khuyến cáo sử dụng EYLEA khi đang cho con bú. Phải quyết định ngừng cho con bú hoặc không sử dụng EYLEA
Bệnh nhân có thể có rối loạn thị lực tạm thời sau khi tiêm trong dịch kính với EYLEA và sau khi thăm khám mắt. Bệnh nhân không nên lái xe hoặc vận hành máy móc cho đến khi chức năng thị giác hồi phục hoàn toàn.
Tóm tắt thông tin an toàn
Quần thể bệnh nhân được đánh giá tính an toàn là tổng số 3102 bệnh nhân điều trị với EYLEA trong
tám nghiên cứu pha III. Trong số đó, 2501 bệnh nhân được điều trị với liều khuyến cáo 2 mg.
Các phản ứng có hại nghiêm trọng liên quan đến quy trình tiêm đã xảy ra với tần suất ít hơn 1/2400 mũi tiêm trong dịch kính với EYLEA và bao gồm viêm mủ nội nhãn, bong võng mạc, đục thủy tinh thể do chấn thương, đục thủy tinh thể, bong dịch kính và tăng áp lực nội nhãn (xem phần Cảnh báo
và thận trọng khi dùng thuốc).
Các phản ứng có hại phổ biến nhất (gặp ở ít nhất 5% số bệnh nhân điều trị bằng EYLEA) là xuất huyết kết mạc, đau ở mắt, đục thủy tinh thể, tăng áp lực nội nhãn, bong dịch kính, đục dịch kính.
Bảng liệt kê các phản ứng có hại
Các dữ liệu an toàn được mô tả dưới đây bao gồm tất cả các phản ứng có hại từ tám nghiên cứu pha
III, có khả năng hợp lý về quan hệ nhân quả với thủ thuật tiêm hoặc thuốc.
Các phản ứng có hại được liệt kê theo phân nhóm hệ cơ quan (MedDRA phiên bản 17.0) và tần suất
được sử dụng theo quy ước sau:
Rất thường gặp (≥1/10 bệnh nhân), thường gặp (≥1/100 đến <1/10 bệnh nhân), ít gặp (≥1/1.000 đến
<1/100 bệnh nhân), hiếm gặp ( 1/10.000 đến < 1/1.000)
Trong mỗi nhóm tần suất, các phản ứng có hại được trình bày theo thứ tự giảm dần về mức độ nghiêm
trọng
Bảng 1: Tất cả các phản ứng có hại xảy ra trong khi điều trị được báo cáo ở các bệnh nhân trong các nghiên cứu pha III (dữ liệu gộp các nghiên cứu pha III cho các chỉ định: wetAMD, CRVO, BRVO, DME và CNV cận thị) hoặc trong giai đoạn giám sát sau lưu hành
| Các hệ cơ quan | Rất thường gặp | Thường gặp | Ít gặp | Hiếm gặp |
| Các rối loạn hệ miễn dịch | Phản ứng quá mẫn*** | |||
| Các rối loạn ở mắ | Xuất huyết kết mạc Đau ở mắt | Rách biểu mô sắc tố võng mạc*, Bong biểu mô sắc tố võng mạc, Đục thủy tinh thể, Đục vỏ thủy tinh thể, Đục nhân thủy tinh thể, Đục thủy tinh thể dưới bao, Mòn giác mạc, Trầy xước giác mạc, Tăng nhãn áp, Nhìn mờ, Ruồi bay, Bong dịch kính, Đau chỗ tiêm, Cảm giác có dị vật trong mắt, Tăng tiết nước mắt, Phù mí mắt, Xuất huyết tại vị trí tiêm, Viêm giác mạc chấm, Sung huyết kết mạc, Sung huyết mắt | Viêm mủ nội nhãn**, Bong võng mạc, Rách võng mạc, Viêm màng bồ đào, Viêm mống mắt, Viêm mống mắt- thể mi, Đục thủy tinh thể, Tổn thương biểu mô giác mạc, Thể lơ lửng trong tiền phòng, Phù giác mạc | Đục thủy tinh thể do chấn thương, Viêm dịch kính , Mủ tiền phòng (Hypopyon) |
* Các tình trạng bệnh lý có liên quan đến AMD thể ướt. Chỉ quan sát thấy trong các nghiên cứu ở bệnh nhân AMD thể ướt.
** Viêm mủ nội nhãn nuôi cấy dương tính và âm tính.
*** Trong giai đoạn sau khi cấp phép lưu hành, các báo cáo về phản ứng quá mẫn bao gồm phát ban, ngứa, mày đay và các trường hợp riêng lẻ về phản ứng phản vệ nặng/kiểu phản vệ
Mô tả một số phản ứng có hại chọn lọc
Các biến cố thuyên tắc huyết khối động mạch
Các biến cố thuyên tắc huyết khối động mạch (ATE) là những biến cố có hại có khả năng liên quan đến sự ức chế VEGF toàn thân. Có nguy cơ về lý thuyết của ATE, bao gồm đột quỵ và nhồi máu cơ tim sau khi sử dụng thuốc ức chế VEGF tiêm trong dịch kính.
Tỷ lệ thấp mắc các biến cố thuyên tắc huyết khối động mạch đã được quan sát trong các thử nghiệm lâm sàng với EYLEA ở bệnh nhân AMD, DME, CRVO, BRVO và CNV cận thị. Trong các chỉ định, không có sự khác biệt đáng kể giữa các nhóm điều trị với aflibercept và các nhóm so sánh tương ứng.
Sinh miễn dịch
Như với tất cả các protein trị liệu, EYLEA có khả năng gây sinh miễn dịch.
Các tác dụng phụ có thể xảy ra trong quá trình sử dụng phải được báo cáo với bác sĩ
Trong các thử nghiệm lâm sàng với các liều lên đến 4 mg, tiêm thuốc hàng tháng và các trường hợp
quá liều đơn lẻ với liều 8 mg được dung nạp tốt.
Quá liều với tăng thể tích tiêm có thể làm tăng áp lực nội nhãn. Vì vậy, trong trường hợp quá liều, nên
theo dõi nhãn áp và nếu bác sĩ điều trị thấy cần thiết, cần bắt đầu điều trị đầy đủ
Nhóm dược điều trị: Các thuốc nhãn khoa / Các thuốc chống tân sinh mạch máu.
Mã ATC: S01LA05
Aflibercept là một protein dung hợp tái tổ hợp bao gồm các phần ngoại bào của thụ thể VEGF 1 và 2 ở người được dung hợp với phần Fc của IgG 1 của người.
Aflibercept được sản xuất từ tế bào K1 của trứng chuột Chinese hamster (Chinese hamster ovary- CHO) bằng công nghệ tái tổ hợp DNA.
Cơ chế tác dụng
Yếu tố tăng trưởng nội mô mạch máu A (VEGF-A) và yếu tố tăng trưởng của nhau thai (PlGF) là thành viên của họ các yếu tố tạo mạch VEGF có thể tác động như các yếu tố có tác dụng phân bào, hóa hướng động, tăng tính thấm thành mạch, đối với các tế bào nội mô. VEGF tác động thông qua hai thụ thể tyrosine kinase, VEGFR-1 và VEGFR-2, hiện diện trên bề mặt của tế bào nội mô. PlGF chỉ liên kết với VEGFR-1, thụ thể này cũng có mặt trên bề mặt của bạch cầu. Hoạt hóa quá mức các thụ thể của VEGF-A có thể dẫn đến tân sinh mạch máu bệnh lý và tăng tính thấm thành mạch quá mức. PlGF có thể hiệp lực với VEGF-A trong các quá trình này, và cũng được biết là thúc đẩy thâm nhiễm bạch cầu và tình trạng viêm mạch máu. Một loạt các bệnh ở mắt, có liên quan đến tân sinh mạch bệnh lý, rò rỉ qua mạch máu, và/hoặc có thể dẫn đến dày và phù nề võng mạc, được cho là góp phần làm giảm thị lực.
Aflibercept tác dụng như là một thụ thể hòa tan bẫy, gắn với VEGF-A và P1GF với ái lực cao hơn các thụ thể tự nhiên của chúng và do vậy có thể ức chế sự gắn kết và hoạt hóa các thụ thể VEGF gốc này. Hằng số phân ly ở trạng thái cân bằng (KD) của aflibercept đối với liên kết VEGF-A165 ở người là 0,5 pM và với VEGF-A121 ở người là 0,36 pM. Các KD đối với liên kết với PlGF-2 người là 39 pM.
Trong các nghiên cứu trên động vật, aflibercept có thể ngăn ngừa sự tạo tân mạch bệnh lý và rò rỉ mạch máu trong một số mô hình bệnh mắt khác nhau. Ví dụ, tiêm trong dịch kính aflibercept cho khỉ đã làm ngăn chặn sự phát triển tân mạch hắc mạc (CNV) đáng kể sau khi gây tổn thương bằng laser, và đảo ngược sự rò rỉ mạch máu từ các tổn thương CNV đã có.
Các đặc tính dược lực học
Thoái hóa hoàng điểm tuổi già có tân sinh mạch (thể ướt) (AMD thể ướt)
AMD thể ướt được đặc trưng bởi sự tân sinh mạch máu bệnh lý ở màng mạch (CNV). Sự rò rỉ máu và dịch từ CNV có thể gây ra phù võng mạc và/ hoặc xuất huyết dưới/trong võng mạc, dẫn đến mất thị lực.
Ở các bệnh nhân điều trị với EYLEA (tiêm một mũi/ tháng trong ba tháng liên tiếp, sau đó tiêm một mũi hàng tháng hoặc mỗi 2 tháng), độ dày của võng mạc giảm xuống ngay sau khi bắt đầu điều trị và kích thước tổn thương CNV trung bình cũng giảm xuống, tương tự với các kết quả quan sát được trên các bệnh nhân dùng ranibizumab 0,5 mg hàng tháng.
Trong năm thứ hai của nghiên cứu, các bệnh nhân tiếp tục sử dụng mức liều mà họ đã nhận khi được phân ngẫu nhiên lúc đầu, nhưng theo chế độ liều được hiệu chỉnh theo đánh giá kết quả điều trị về thị lực và giải phẫu, với khoảng cách tối đa giữa hai lần tiêm được xác định trước trong đề cương nghiên cứu là 12 tuần.
Trong nghiên cứu VIEW1, có các mức giảm trung bình về độ dày võng mạc khi đánh giá bằng chụp cắt lớp gắn dính quang học (optical coherence tomography -OCT) (các nhóm nghiên cứu sử dụng EYLEA 0,5 mg hàng tháng, 2 mg hàng tháng, 2 mg mỗi hai tháng và ranibizumab 0,5 mg hàng tháng có mức giảm lần lượt là 123, 121, 130 và 129 micron ở tuần 52).
Cũng tại thời điểm đánh giá ở tuần 52, trong nghiên cứu VIEW2, có mức giảm trung bình độ dày võng mạc trên OCT (các nhóm nghiên cứu sử dụng EYLEA 0,5 mg hàng tháng, 2 mg hàng tháng, 2 mg mỗi hai tháng, và ranibizumab 0,5 mg mỗi tháng có mức giảm lần lượt là 130, 157, 149 và 139 micron).
Sự giảm kích thước CNV và giảm độ dày võng mạc nhìn chung vẫn duy trì trong năm thứ hai của nghiên cứu.
Nghiên cứu ALTAIR trên bệnh nhân wAMD điều trị lần đầu, cho kết quả tương tự các nghiên cứu VIEW khi tiêm EYLEA 2mg mỗi tháng trong 3 tháng đầu, tiếp nối bởi một mũi tiêm sau 2 tháng và tiếp tục bằng chế độ liều điều trị và mở rộng (T&E) với khoảng điều trị thay đổi dựa trên những tiêu chuẩn định trước (mở rộng 2 tuần hoặc 4 tuần) có thể đạt khoảng cách điều trị tối đa đến 16 tuần.
Ở tuần 52, đạt được mức giảm trung bình độ dày võng mạc trung tâm trên OCT là -134,4 và -126,1 microns lần lượt cho nhóm mở rộng khoảng điều trị 2 tuần và 4 tuần . Tỉ lệ bệnh nhân hết dịch trên OCT ở tuần 52 là 68,3% và 69,1% lần lượt trên nhóm mở rộng khoảng điều trị 2 tuần và 4 tuần.
Ở những bệnh nhân bị bệnh lý mạch máu dạng polyp ở hắc mạc (polypoidal choroidal vasculopathy - PCV), một phân nhóm của AMD thể ướt, được tiêm 3 mũi EYLEA 2 mg hàng tháng, tiếp theo là tiêm EYLEA 2 mg mỗi hai tháng (nghiên cứu PLANET), đã thu được kết quả tương tự với các nghiên cứu VIEW. Ở tuần 52, có sự giảm độ dày võng mạc trung bình trên OCT 138 micron đối với nhóm dùng EYLEA 2 mg mỗi 2 tháng và 144 micron đối với nhóm dùng EYLEA 2 mg cộng với liệu pháp giải cứu bằng quang động (PDT) khi có chỉ định (xem phần Hiệu quả lâm sàng - Thoái hóa hoàng điểm tuổi già có tân sinh mạch (AMD ướt).
Phù hoàng điểm thứ phát do tắc nghẽn tĩnh mạch võng mạc trung tâm (CRVO)
Ở bệnh nhân CRVO, thiếu máu võng mạc xuất hiện và dẫn đến giải phóng VEGF, điều này gây mất ổn định các liên kết chặt chẽ giữa các tế bào nội mô và thúc đẩy sự tăng sinh tế bào nội mô. Việc tăng điều tiết của VEGF có liên quan đến sự phá vỡ hàng rào máu võng mạc và điều này làm tăng tính thấm thành mạch dẫn đến phù nề võng mạc, kích thích tăng trưởng tế bào nội mô và tân sinh mạch máu.
Ở những bệnh nhân được điều trị bằng EYLEA (tiêm một lần mỗi tháng trong sáu tháng), đã có đáp ứng phù hợp, nhanh chóng và mạnh mẽ về hình thái (độ dày võng mạc trung tâm [CRT] được đánh giá qua OCT). Những cải thiện về CRT trung bình được duy trì qua tuần 24.
Độ dày võng mạc trên OCT ở tuần 24 so với trước điều trị là một thông số hiệu quả thứ cấp trong cả hai nghiên cứu COPERNICUS và GALILEO. Trong cả hai nghiên cứu, sự thay đổi trung bình của CRT từ lúc đầu điều trị đến tuần 24 là có ý nghĩa thống kê, tốt hơn ở nhóm EYLEA.
Bảng 2: Thông số dược lực học ở tuần 24, tuần 52 và tuần 76/100 (toàn bộ quần thể nghiên cứu [Full Analysis Set] với LOCF) trong các nghiên cứu COPERNICUS và GALILEO
|
Hiệu quả điều trị
|
COPERNICUS |
|||||||||||||
|
24 tuần |
52 tuần |
100 tuần |
||||||||||||
|
EYLEA
|
Nhóm
|
EYLEA
|
Nhóm
|
EYLEAD)
|
Nhóm
|
|||||||||
|
Sự thay đổi trung bình về độ dày võng mạc so với |
-457
|
-145
|
-413
|
-382
|
-390
|
-343
|
||||||||
|
Sự khác biệt về trung bình
|
|
|
|
|
|
|
||||||||
|
Hiệu quả điều trị |
GALILEO |
|||||||||||||
|
24 tuần |
52 tuần |
76 tuần |
||||||||||||
|
EYLEA |
Nhóm |
EYLEA |
Nhóm |
EYLEAE) |
Nhóm |
|||||||||
|
Sự thay đổi trung bình về |
-449 |
-169 |
-424 |
-219 |
-389 |
-306 |
||||||||
|
|
|
|
|
|
|
||||||||
Phù hoàng điểm thứ phát do tắc nghẽn nhánh tĩnh mạch võng mạc - BRVO
Ở bệnh nhân BRVO, thiếu máu võng mạc xuất hiện và dẫn đến giải phóng VEGF, điều này gây mất ổn định các liên kết chặt chẽ giữa các tế bào nội mô và thúc đẩy sự tăng sinh tế bào nội mô. Việc tăng điều tiếtcủa VEGF có liên quan đến sự phá vỡ hàng rào máu võng mạc và điều này làm tăng tính thấm thành mạch dẫn đến phù nề võng mạc, kích thích tăng trưởng tế bào nội mô và tân sinh mạch máu.
Ở những bệnh nhân được điều trị bằng EYLEA (tiêm một lần mỗi tháng trong sáu tháng), đã có đáp ứng phù hợp, nhanh chóng và mạnh mẽ về hình thái (độ dày võng mạc trung tâm [CRT] được đánh giá qua OCT).
Có một cải thiện đáng kể có ý nghĩa thống kê ở nhóm dùng EYLEA 2 mg so với nhóm chứng ở tuần 24 (-280 micron so với -128 micron). Ở tuần 24 khoảng thời gian giữa hai lần tiêm thuốc đã được nới rộng lên mỗi 2 tháng và các kết quả điều trị về giải phẫu học vẫn được duy trì.
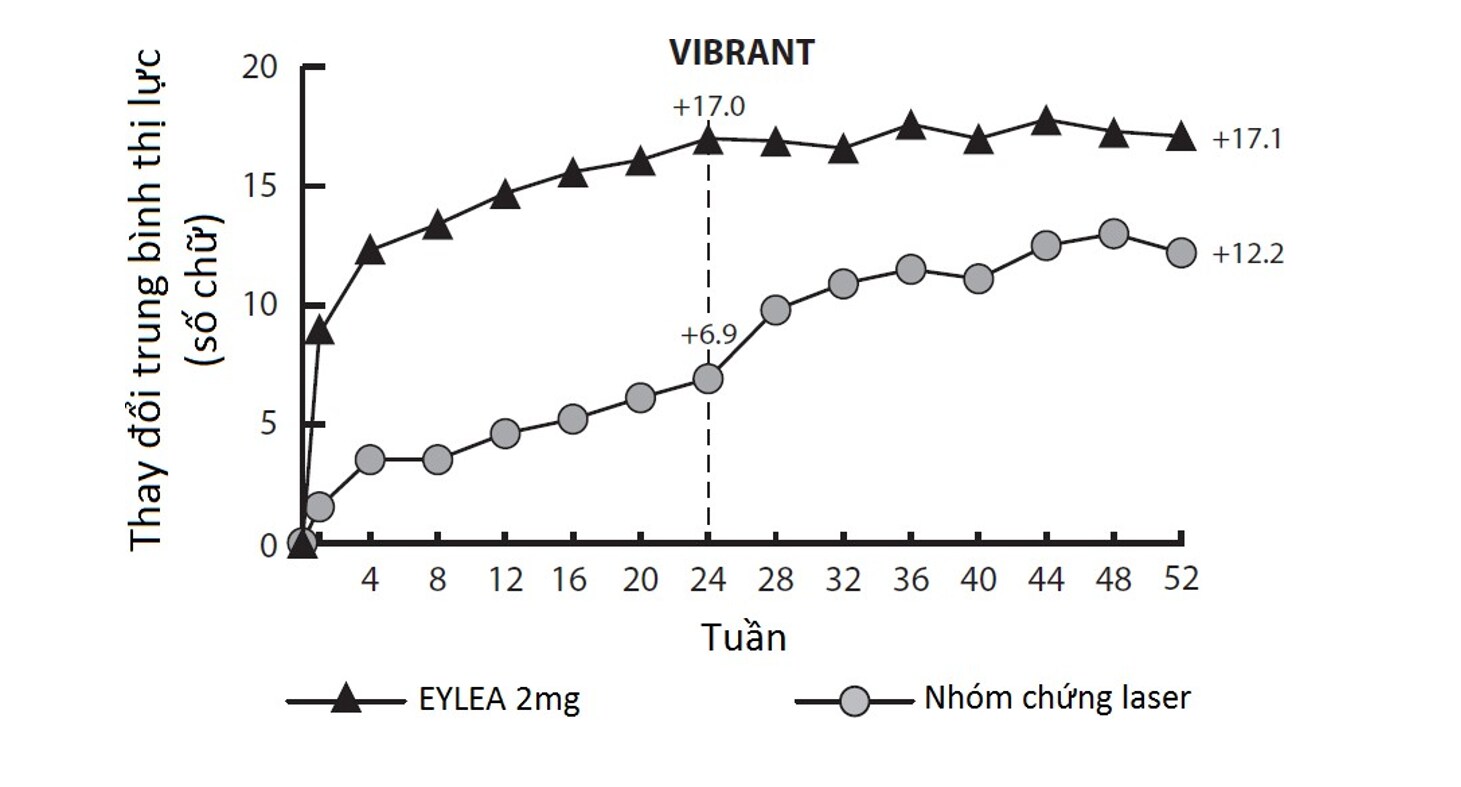
Độ dày võng mạc trên OCT ở tuần 24 so với trước điều trị là một thông số hiệu quả thứ cấp trong nghiên cứu VIBRANT. Mức giảm so với trước điều trị này được duy trì đến tuần 52, tốt hơn ở nhóm EYLEA.
Bảng 3: Thông số dược lực học ở tuần 24 và ở tuần 52 (toàn bộ quần thể nghiên cứu [Full Analysis Set] với LOCF) trong nghiên cứu VIBRANT
|
Hiệu quả điều trị |
VIBRANT |
|||
|
24 tuần |
52 tuần |
|||
|
EYLEA 2 mg Q4 (N = 91) |
Nhóm chứng có |
EYLEA 2 mg Q8 B) |
Nhóm chứng |
|
|
Sự thay đổi trung bình về |
-280 |
-128 |
-284 |
- 249 |
|
Sự khác biệt về trung bình giá trị p |
-149 p < 0,0001 |
|
30 p=0,0218 |
|
A) Sự khác biệt được tính là kết quả nhóm EYLEA 2 mg mỗi 4 tuần trừ kết quả của nhóm chứng
B) LS: Sự khác biệt giá trị trung bình (phương pháp bình phương tối thiểu), khoảng tin cậy 95% (CI) được dựa trên một mô hình ANCOVA với kết quả đo trước điều trị là đồng biến và các yếu tố là nhóm điều trị, khu vực (Mỹ so với phần còn lại của thế giới trong nghiên cứu COPERNICUS và Châu Âu so với vùng châu Á/Thái Bình Dương trong nghiên cứu GALILEO), và phân loại thị lực tốt nhất sau chỉnh kính (Best Corrected Visual Acuity - BCVA ≤ 20/200 và BCVA> 20/200).
C) Trong nghiên cứu COPERNICUS, các bệnh nhân ở nhóm chứng có thể được sử dụng EYLEA trên cơ sở nếu thấy cần thiết với tần suất có thể thường xuyên mỗi 4 tuần trong giai đoạn từ tuần 24 đến tuần 52; các bệnh nhân có các lần thăm khám mỗi 4 tuần.
D) Trong nghiên cứu COPERNICUS, các bệnh nhân ở cả nhóm chứng và nhóm dùng EYLEA 2mg, được sử dụng EYLEA 2 mg trên cơ sở nếu thấy cần thiết với tần suất có thể thường xuyên mỗi 4 tuần bắt đầu từ tuần 52 đến tuần 96; các bệnh nhân có các lần thăm khám bắt buộc mỗi quý nhưng có thể được thăm khám với tần suất mỗi 4 tuần nếu cần.
E) Trong nghiên cứu GALILEO các bệnh nhân cả ở nhóm chứng và nhóm dùng EYLEA 2mg, được sử dụng EYLEA 2 mg trên cơ sở nếu thấy cần thiết với tần suất là mỗi 8 tuần bắt đầu từ tuần 52 đến tuần 68; các bệnh nhân có các lần thăm khám bắt buộc mỗi 8 tuần.
Phù hoàng điểm do đái tháo đường - DME
Phù hoàng điểm do đái tháo đường được đặc trưng bởi tăng tính thấm thành mạch và tổn thương các mao mạch võng mạc, có thể dẫn đến mất thị lực.
Ở những bệnh nhân được điều trị bằng EYLEA, đã quan sát thấy có đáp ứng nhanh và mạnh mẽ về hình thái học (độ dày võng mạc trung tâm [CRT] qua đánh giá bằng OCT) ngay sau khi bắt đầu điều trị. Sự thay đổi trung bình về CRT từ lúc trước điều trị đến tuần 52 là có ý nghĩa thốn
Bảng 4: Thông số dược lực học ở tuần 52 và tuần 100 (toàn bộ quần thể nghiên cứu [Full Analysis Set] với LOCF) trong nghiên cứu VIVIDDME
|
Hiệu quả điều trị |
VIVIDDME |
VIVIDDME |
|||||||
|
52 tuần |
100 tuần |
||||||||
|
|
EYLEA 2 mg Q8 A) |
EYLEA 2 mg Q4 C) (N = 136) |
Nhóm chứng có điều trị (laser) |
EYLEA 2 mg Q8 A) (N = 135) |
EYLEA 2 mg Q4 (N = 136) |
Nhóm chứng điều trị (laser) (N = 132) |
có |
||
|
|
(N = 135) |
|
(N = 132) |
|
|
||||
|
Sự |
thay |
đổi |
|
|
|
|
|
|
|
|
trung CRT trước |
bình so điều |
về với trị |
-192,4 (149,89) |
-195,0 (146,59) |
-66,2 (138,99) |
-195,8 (141,75) |
-211,8 (150,87) |
-85,7 (145,84) |
|
|
(SD) |
|
|
|
|
|
|
|
|
|
|
Sự khác biệt về trung bình LS A,B) (khoảng tin cậy 97,5% ) giá trị p |
-142,8 |
-157,0 |
|
-126,8 |
-154,4 |
|
|||
|
(-179,3, |
(-190,9, |
(-164,6 |
(-189,1, |
||||||
|
-106,3) |
-123,1) |
-89,0) |
-119,7) |
||||||
|
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
||||||
A) Trung bình LS và khoảng tin cậy được tính dựa trên một mô hình ANCOVA với giá trị đo BCVA trước điều trị là đồng biến và một yếu tố là nhóm điều trị. Ngoài ra, khu vực (Châu Âu/ Úc so với Nhật Bản) đã được đưa vào như là một yếu tố trong nghiên cứu VIVIDDME, và tiền sử nhồi máu cơ tim (MI) và/hoặc tai biến mạch máu não (CVA) như một yếu tố trong nghiên cứu VISTADME).
EYLEA 2 mg Q8: Từ tuần 16 trở đi, khoảng cách giữa các lần tiêm trong nhóm điều trị EYLEA được kéo dài từ 4 tuần lên 8 tuần ở tất cả các đối tượng.
B) Sự khác biệt được tính là kết quả của nhóm EYLEA trừ kết quả của nhóm chứng có điều trị (laser)
C) EYLEA tiêm 2 mg mỗi 4 tuần
Bảng 5: Thông số dược lực học ở tuần 52 và tuần 100 (toàn bộ quần thể nghiên cứu với LOCF) trong nghiên cứu VISTADME
|
Hiệu quả điều trị |
VISTADME |
VISTADME |
||||
|
52 tuần |
100 tuần |
|||||
|
EYLEA 2 mg Q8 A) (N = 151) |
EYLEA 2 mg Q4 C) (N = 154) |
Nhóm chứng có điều trị (laser) (N = 154) |
EYLEA 2 mg Q8 A) (N = 151) |
EYLEA 2 mg Q4 (N = 154) |
Nhóm chứng có điều trị (laser) (N = 154) |
|
|
Sự thay đổi trung bình về CRT so với trước điều trị (SD) |
-183,1 (153,50) |
-185,9 (150,68) |
-73,3 (176,72) |
-191,1 (160,66) |
-191,4 (180,01) |
-83,9 (179,29) |
|
Sự khác biệt về trung bình LS A, B) (khoảng tin cậy 97,5%) giá trị p |
-113,47 (-144,19, -82,75) p < 0,0001 |
-110,78 (-141,34, -80,22) p < 0,0001 |
|
-110,99 (-142,94 - 79,04) p < 0,0001 |
-104,89 (-139,58, -70,21) p < 0,0001 |
|
A ) Trung bình LS và khoảng tin cậy dựa trên một mô hình ANCOVA với giá trị đo BCVA trước điều trị là đồng biến và một yếu tố là nhóm điều trị. Ngoài ra, khu vực (Châu Âu/ Úc so với Nhật Bản) đã được đưa vào như là một yếu tố trong nghiên cứu VIVIDDME, và tiền sử nhồi máu cơ tim (MI) và/hoặc tai biến mạch máu não (CVA) như một yếu tố trong nghiên cứu VISTADME).
EYLEA 2 mg Q8: Từ tuần 16 trở đi, khoảng cách giữa các lần tiêm trong nhóm điều trị EYLEA được kéo dài từ 4 tuần lên 8 tuần ở tất cả các đối tượng.
B) Sự khác biệt được tính là kết quả của nhóm EYLEA trừ kết quả của nhóm chứng có điều trị (laser)
C) EYLEA tiêm 2 mg mỗi 4 tuần.
Tân mạch hắc mạc do cận thị (CNV cận thị)
Tân mạch hắc mạc do cận thị (CNV cận thị) là nguyên nhân thường gặp gây giảm thị lực ở người trưởng thành có cận thị bệnh lý. Mắt có cận thị bệnh lý bị kéo dài trục, thường là quá mức, và có thêm các thay đổi mô bệnh học như mỏng và dị dạng lớp biểu mô sắc tố võng mạc, các vết rạn dạng vệt sơn (lacquer cracks) và vỡ màng Bruch, tân mạch hắc mạc, xuất huyết dưới võng mạc, và teo hắc mạc. Với hậu quả của vỡ màng Bruch, CNV cận thị hình thành như là một cơ chế làm lành vết thương, đồng thời là biến chứng đe dọa thị lực nhất trong cận thị bệnh lý.
Ở những bệnh nhân điều trị bằng EYLEA (tiêm một lần khi bắt đầu điều trị, tiêm bổ sung trong trường hợp bệnh vẫn còn tồn tại hoặc tái phát), độ dày võng mạc được đánh giá bằng OCT đã giảm ngay sau khi bắt đầu điều trị và kích thước tổn thương CNV trung bình được thu hẹp. Sự thay đổi trung bình của CRT từ trước khi điều trị so với tuần 24 là có ý nghĩa thống kê, tốt hơn đối với EYLEA.
Bảng 6: Thông số dược lực học ở tuần 24 và tuần 48 trong nghiên cứu MYRROR (toàn bộ quần thể nghiên cứu với LOCFA))
|
Các kết quả về hiệu quả |
MYRROR |
|||
|
24 Tuần |
48 Tuần |
|||
|
EYLEA 2mgB) (N = 90) |
Giả điều trị (N = 31) |
EYLEA 2mgC) (N = 90) |
Giả điều trị/ EYLEA 2mgD) (N = 31) |
|
|
Thay đổi trung bình về độ dày võng mạc trung tâm so với trước điều trị |
-79 |
-4 |
-83 |
-57 |
|
Sự khác biệt về trung bình LS E,F,G,H) (95% CI) giá trị p |
-78 (-109, -47) p < 0.0001 |
|
-29 (-60; 2) P=0.0650 |
|
A) LOCF (Last Observation Carried Forward): Sử dụng kết quả đo được cuối cùng cho giá trị đo bị mất
B) EYLEA 2mg được tiêm vào lúc ban đầu và có thể mỗi 4 tuần một lần nếu bệnh vẫn còn hoặc tái phát.
C) EYLEA 2 mg tiêm từ tuần 24 đến tuần 44, có thể mỗi 4 tuần một lần trong trường hợp bệnh vẫn còn hoặc tái phát
D) Bắt buộc tiêm EYLEA 2mg vào Tuần 24, sau đó có thể tiêm mỗi 4 tuần một lần trong trường hợp bệnh vẫn còn hoặc tái phát cho đến Tuần 44.
E) Sự khác biệt là kết quả đo ở nhóm dùng EYLEA 2mg trừ đi kết quả ở nhóm giả điều trị ở Tuần 24, sự khác biệt là kết quả đo ở nhóm dùng EYLEA 2mg trừ đi kết quả đo ở nhóm giả điều trị/ EYLEA 2mg ở Tuần 48.
F) Trung bình LS: Giá trị trung bình tính theo phương pháp bình phương tối thiểu từ mô hình ANCOVA
G) CI: Khoảng tin cậy
H) Sự khác biệt trung bình LS và CI 95% được tính dựa trên mô hình ANCOVA với yếu tố ảnh hưởng cố định là nhóm điều trị và quốc gia (thiết kế theo quốc gia) và đồng biến là BCVA trước điều trị.
Hiệu quả lâm sàng
Thoái hóa hoàng điểm tuổi già có tân sinh mạch (AMD thể ướt)
Tính an toàn và hiệu quả của EYLEA được đánh giá trong hai nghiên cứu ngẫu nhiên, đa trung tâm, mù đôi (double-masked), so sánh với nhóm chứng có điều trị, ở những bệnh nhân AMD thể ướt. Tổng cộng có 2412 bệnh nhân đã được điều trị và có thể đánh giá tính hiệu quả (1817 điều trị với EYLEA) trong hai nghiên cứu (VIEW1 và VIEW2). Trong mỗi nghiên cứu, các bệnh nhân được phân ngẫu nhiên theo tỷ lệ 1: 1: 1: 1 vào 1 trong 4 nhóm chế độ liều:
1) EYLEA tiêm ở liều 2 mg mỗi 8 tuần sau khi tiêm 3 liều hàng tháng ban đầu (EYLEA 2Q8).
2) EYLEA tiêm ở liều 2 mg mỗi 4 tuần (EYLEA 2Q4).
3) EYLEA tiêm ở liều 0,5 mg mỗi 4 tuần (EYLEA 0,5Q4) và
4) Ranibizumab tiêm ở liều 0,5 mg mỗi 4 tuần (Ranibizumab 0,5Q4) Tuổi bệnh nhân dao động từ 49-99 tuổi, tuổi trung bình là 76 tuổi.
Trong năm thứ hai của các nghiên cứu, các bệnh nhân tiếp tục dùng mức liều mà họ đã dùng ban đầu lúc phân ngẫu nhiên nhưng với một chế độ liều thay đổi dựa vào đánh giá kết quả điều trị về thị lực và giải phẫu với khoảng thời gian tối đa giữa hai lần tiêm thuốc được xác định trước trong đề cương nghiên cứu là 12 tuần.
Trong năm thứ hai của các nghiên cứu, 90% bệnh nhân ban đầu được điều trị bằng EYLEA 2Q8 được dùng ít hơn hoặc bằng 6 liều và 72% nhận được ít hơn hoặc bằng 4 liều trong số những bệnh nhân hoàn thành năm thứ hai của nghiên cứu.
Trong cả hai nghiên cứu, tiêu chí chính để đánh giá hiệu quả là tỷ lệ bệnh nhân trong nhóm phân tích theo đề cương (Per Protocol Set) duy trì được thị lực, được định nghĩa là mất ít hơn 15 chữ cái của phép đo thị lực ở tuần 52 so với trước điều trị.
Trong nghiên cứu VIEW1, ở tuần 52, 95,1% bệnh nhân trong nhóm điều trị EYLEA 2Q8, 95,1% bệnh nhân trong nhóm điều trị EYLEA 2Q4, và 95,9% bệnh nhân trong nhóm điều trị EYLEA 0,5Q4 duy trì được thị lực so với 94,4% bệnh nhân trong nhóm ranibizumab 0,5Q4. Tất cả các nhóm điều trị EYLEA đã được chứng minh là không thua kém và tương đương lâm sàng với nhóm ranibizumab 0,5Q4.
Trong nghiên cứu VIEW2, ở tuần 52, 95,6% bệnh nhân trong nhóm điều trị EYLEA 2Q8, 95,6% bệnh nhân trong nhóm điều trị EYLEA 2Q4, và 96,3% bệnh nhân trong nhóm điều trị EYLEA 0,5Q4 duy trì thị lực so với 94,4% bệnh nhân trong nhóm ranibizumab 0,5Q4. Tất cả các nhóm điều trị EYLEA đã được chứng minh là không thua kém và tương đương lâm sàng với nhóm ranibizumab 0,5Q4.
Các kết quả chi tiết từ việc phân tích kết hợp của cả hai nghiên cứu được trình bày trong Bảng và Hình dưới đây.
Bảng 7: Các kết quả về hiệu quả điều trị ở tuần 52 (phân tích ban đầu) và tuần 96; số liệu tổng hợp từ các nghiên cứu VIEW1 và VIEW2B)
|
Hiệu quả điều trị |
EYLEA 2 mg Q8E) (n = 607) |
EYLEA 2 mg Q4 (n = 613) |
EYLEA 0,5 mg Q4 (n = 597) |
Ranibizumab 0,5 mg Q4 (n = 595) |
||||
|
|
52 tuần |
96 tuần |
52 tuần |
96 tuần |
52 tuần |
96 tuần |
52 tuần |
96 tuần |
|
Số lượng mũi tiêm trung bình |
7,6 |
11,2 |
12,3 |
16,0 |
12,2 |
16,2 |
12,3 |
16,5 |
|
Tỷ lệ bệnh nhân duy trì được thị lực (mất < 15 chữ cái khi đo BCVAA) )(quần thể phân tích theo đề cương -Per Protocol Set) |
95,33%B) |
92,42% |
95,35%B) |
92,17% |
96,10%B) |
91,46% |
94,42%B) |
91,60% |
|
Sự khác biệtC) (khoảng tin cậy 95%)D) |
0,9% (-1,7, 3,5)F) |
0,8% (-2,3, 3,8)F) |
0,9% (-1,7, 3,5)F) |
0,6% (-2,5, 3,6)F) |
1,7% (-0,9, 4,2)F) |
-0,2% (-3,3, 3,0)F |
|
|
|
Thay đổi trung bình về BCVA so với trước điều trị đo bởi điểm chữ cái trong ETDRSA) |
8,40 |
7,62 |
9,26 |
7,60 |
8,29 |
6,59 |
8,74 |
7,89 |
|
Sự khác biệt về thay đổi trung bình LSA) (chữ cái ETDRS)C) (khoảng tin cậy 95%)D) |
-0,32 (-1,87, 1,23) |
-0,25 (-1,98, 1,49 |
0,60 (-0,94, 2,14) |
-0,20 (-1,93, 1,53) |
-0,43 (-1,99, 1,12) |
-1,28 (-3,02, 0,46) |
|
|
|
Tỷ lệ bệnh nhân xác định được thêm ít nhất 15 chữ cái trong phép đo thị lực so với trước điều trị |
30,97% |
33,44% |
33,44% |
31,16% |
29,82% |
28,14% |
32,44% |
31,60% |
|
Sự khác biệtC) (khoảng tin cậy 95%)D) |
-1,5% (-6,8, 3,8) |
1,8% (-3,5, 7,1) |
1,0% (-4,3, 6,3) |
-0,4% (-5,6, 4,8) |
-2,7% (-7,9, 2,6) |
-3,5 (-8,7, 1,7) |
|
|
A) BCVA (Best Corrected Visual Acuity): Thị lực tốt nhất sau chỉnh kính
ETDRS (Early Treatment Diabetic Retinopathy Study): Nghiên cứu điều trị sớm bệnh lý võng mạc do đái tháo đường
LS: Giá trị trung bình (phương pháp bình phương tối thiểu) xác định từ phân tích ANCOVA
B) Phân tích trên toàn bộ quần thể (Full Analysis Set -FAS). Phương pháp lấy kết quả lần đo cuối cùng thay thế cho dữ liệu bị mất (Last Observation Carried Forward -LOCF) đối với tất cả các phân tích số liệu ngoại trừ tỷ lệ bệnh nhân duy trì thị lực ở tuần 52, trong đó sử phân tích trên quần thể theo đề cương nghiên cứu (Per Protocol Set - PPS)
C) Sự khác biệt là giá trị của các nhóm EYLEA trừ đi giá trị của nhóm ranibizumab. Một giá trị dương tốt hơn cho EYLEA.
D) Khoảng tin cậy (Confidence interval - CI) được tính từ ước lượng theo phân phối chuẩn
E) Sau khi bắt đầu điều trị với ba liều hàng tháng
F) Một khoảng tin cậy nằm hoàn toàn trong khoảng trên -10% chỉ ra sự không thua kém của EYLEA so với ranibizumab
Hình 1: Sự thay đổi trung bình về thị lực từ lúc bắt đầu điều trị đến tuần 96, số liệu kết hợp từ các nghiên cứu VIEW1 và VIEW2.

Giảm diện tích CNV trung bình là rõ ràng ở tất cả các nhóm liều trong cả hai nghiên cứu.
Trong phân tích dữ liệu kết hợp của các nghiên cứu VIEW1 và VIEW2, EYLEA ở tất cả các liều(2Q8, 2Q4 và 0,5Q4) đã chứng minh sự thay đổi có ý nghĩa lâm sàng so với ban đầu về các tiêu chíđánh giá hiệu quả thứ cấp được xác định trước trên bộ câu hỏi về chức năng thị lực của Viện MắtQuốc gia (National Eye Institute Visual Function Questionnaire - NEI VFQ-25). Độ lớn của nhữngthay đổi này là tương tự như đã thấy trong các nghiên cứu được xuất bản, tương ứng với mức tăng 15chữ cái trong phép đo thị lực tốt nhất sau chỉnh kính (BCVA).
Không thấy có sự khác biệt có ý nghĩa giữa EYLEA và thuốc đối chứng ranibizumab về những thay đổi của tổng số điểm NEI VFQ-25 và các điểm thành phần (các hoạt động gần, hoạt động xa và sự phụ thuộc vào thị lực) ở tuần 52 so với trước điều trị.
Trong năm thứ hai của nghiên cứu, hiệu quả nhìn chung được duy trì cho đến lần đánh giá cuối cùng vào tuần 96. Trong khoảng thời gian 2 năm, các bệnh nhân trong nhóm EYLEA 2Q8 nhận được trung bình 11,2 liều và bệnh nhân trong nhóm ranibizumab nhận được trung bình 16,5 liều. Kết quả về hiệu quả điều trị trong tất cả các phân nhóm đánh giá được (ví dụ tuổi, giới tính, chủng tộc, thị lực trước điều trị, loại tổn thương, kích thước tổn thương) trong mỗi nghiên cứu và phân tích kết hợp là phù hợp với các kết quả trong các quần thể chung.
ALTAIR là một nghiên cứu đa trung tâm, ngẫu nhiên, mở nhãn, pha IV trên 247 bệnh nhân wAMD điều trị lần đầu, được thiết kế nhằm đánh giá hiệu quả và độ an toàn của EYLEA trên hai khoảng điều trị thay đổi (mở rộng 2 tuần và 4 tuần) của chế độ liều điều trị và mở rộng (T&E).
Tất cả bệnh nhân được tiêm một mũi EYLEA 2mg mỗi tháng trong 3 tháng đầu, tiếp nối bởi một mũi tiêm sau 2 tháng. Tại tuần 16, bệnh nhân được phân ngẫu nhiên 1:1 vào hai nhóm điều trị: 1) EYLEA điều trị và mở rộng 2 tuần và 2) EYLEA điều trị và mở rộng 4 tuần.
Mở rộng hoặc thu hẹp khoảng điều trị được quyết định dựa trên những tiêu chuẩn về thị lực và/hoặc giải phẫu xác định bởi đề cương nghiên cứu với khoảng điều trị tối đa là 16 tuần cho cả 2 nhóm.
Tiêu chí hiệu quả chính là sự thay đổi trung bình thị lực tốt nhất sau chỉnh kính (BCVA) tại tuần 52 so với trước điều trị. Tiêu chí hiệu quả phụ là tỉ lệ bệnh nhân không mất ≥15 chữ cái và tỉ lệ bệnh nhân cải thiện ≥15 chữ cái của BCVA tại tuần 52 so với trước điều trị.
Tại tuần 52, bệnh nhân ở nhóm điều trị và mở rộng 2 tuần đã cải thiện trung bình 9,0 chữ cái so với trước điều trị, so với 8.4 chữ cái so với trước điều trị ở nhóm điều trị và mở rộng 4 tuần [sự khác biệt trung bình về số chữ cái theo phương pháp bình phương tối thiểu (95% CI): -0,4 (-3,8;3,0), ANCOVA]. Tỉ lệ bệnh nhân không mất ≥15 chữ cái ở hai nhóm là tương đương (96,7% ở nhóm mở rộng 2 tuần và 95,9% ở nhóm mở rộng 4 tuần). Tỉ lệ bệnh nhân cải thiện ≥15 chữ cái ở tuần 52 là 32,5% ở nhóm mở rộng 2 tuần và 30,9% ở nhóm mở rộng 4 tuần. Tỉ lệ bệnh nhân mở rộng khoảng điều trị đến 12 tuần hoặc dài hơn là 42,3% ở nhóm mở rộng 2 tuần và 49,6 % ở nhóm mở rộng 4 tuần. Bên cạnh đó, ở nhóm điều trị và mở rộng 4 tuần có 40,7% bệnh nhân đã mở rộng đến khoảng điều trị 16 tuần. Lần thăm khám cuối cùng trước tuần 52, 56,7% và 57,8% bệnh nhân lần lượt ở hai nhóm mở rộng 2 tuần và 4 tuần có lịch trình tiêm ở khoảng điều trị 12 tuần hoặc dài hơn. Hồ sơ an toàn thị lực và hệ thống tương đồng với độ an toàn quan sát thấy trong các nghiên cứu khởi đầu VIEW1 và VIEW2.
Một nghiên cứu ngẫu nhiên, mù đôi, đa trung tâm, có đối chứng giả điều trị phase IIIb/IV (PLANET) của EYLEA đơn trị liệu so với EYLEA phối hợp với với điều trị quang động giải cứu (photodynamic therapy -PDT) đã được tiến hành trên 333 bệnh nhân bị bệnh lý mạch máu dạng polyp ở hắc mạc có triệu chứng (PCV), một phân nhóm của AMD thể ướt, chưa từng điều trị, được chẩn đoán bằng chụp mạch xanh indocyanine (indocyanine green angiography- ICGA). Tất cả các bệnh nhân đều được tiêm 3 liều EYLEA 2 mg mỗi tháng và sau đó được phân ngẫu nhiên theo tỷ lệ 1: 1 thành hai nhóm điều trị: 1) EYLEA 2 mg cộng với PDT giả (n = 157) hoặc 2) EYLEA 2 mg cộng với PDT điều trị (n = 161). PDT chỉ được dùng nếu đáp ứng các tiêu chí giải cứu. Bệnh nhân ở cả hai nhóm được tiêm một mũi EYLEA 2 mg mỗi hai tháng. Những bệnh nhân đủ điều kiện giải cứu đã được tiêm EYLEA 2 mg hàng tháng cộng với PDT có tác dụng điều trị hoặc PDT giả. Khi các kết quả về thị lực và giải phẫu cho phép, các khoảng cách giữa các lần điều trị đã được kéo dài đến hai tháng ở nhóm các bệnh nhân giải cứu. Tiêu chí giải cứu là độ tăng BCVA chưa đủ, thấy có dịch trên OCT và bằng chứng của polyp hoạt động trên ICGA.
Tiêu chí đánh giá hiệu quả chính là thay đổi trung bình của BCVA từ thời điểm ban đầu so với tuần 52. Tiêu chí đánh giá hiệu quả phụ là tỷ lệ bệnh nhân không mất ≥15 BCVA từ ban đầu so với tuần 52.
Ở tuần 52, bệnh nhân ở nhóm EYLEA cộng với điều trị giả PDT đạt được trung bình 10,7 kí tự so với 10,8 ký tự trong nhóm EYLEA cộng với bệnh nhân PDT có tác dụng điều trị trong toàn bộ quần thể nghiên cứu [sự khác biệt LS trung bình về số chữ cái (95% CI): -0.7 ( -2,9,1,6), ANCOVA]. Tỷ lệ bệnh nhân không mất ≥15 chữ cái là 97,5% ở nhóm EYLEA cộng với PDT giả và 96,9% ở nhóm EYLEA cộng với PDT có tác dụng điều trị [sự khác biệt đã điều chỉnh xác định từ mô hình CMH, tính theo % (95% CI): 0,6 (-3,1; 4.3)], cho thấy sự không thua kém của cả hai phương pháp điều trị đối với cả tiêu chí chính (biên NI là 5 chữ cái) và tiêu chí phụ (biên NI 7 điểm phần trăm). Không có bằng chứng về polyp hoạt động được ghi nhận ở 81,7% bệnh nhân trong nhóm EYLEA cộng PDT giả và 88,9% bệnh nhân trong nhóm EYLEA cộng với PDT có tác dụng điều trị. 86,8% bệnh nhân không cần điều trị giải cứu trong suốt năm đầu tiên. Dữ liệu thu thập được từ những bệnh nhân đủ điều kiện cho điều trị giải cứu PDT (n = 42, 13.2%) không cho thấy lợi ích gia tăng trên BCVA khi dùng kết hợp verteporfin PDT và EYLEA so với đơn trị liệu của EYLEA. Dữ liệu về tính an toàn tại mắt và toàn thân tương tự như dữ liệu về độ an toàn quan sát được trong các nghiên cứu then chốt VIEW1 và VIEW2.
Bệnh nhân người cao tuổi
Trong các nghiên cứu then chốt VIEW trên bệnh nhân AMD thể ướt, khoảng 89% (1616/1817) số bệnh nhân được phân ngẫu nhiên để điều trị với EYLEA là từ 65 tuổi trở lên và khoảng 63% (1139/1817) là từ 75 tuổi trở lên.
Phù hoàng điểm thứ phát do tắc nghẽn tĩnh mạch võng mạc trung tâm (CRVO)
Tính an toàn và hiệu quả của EYLEA được đánh giá trong hai nghiên cứu ngẫu nhiên, đa trung tâm, mù đôi, đối chứng giả, ở những bệnh nhân có phù hoàng điểm thứ phát với CRVO. Tổng cộng có 358 bệnh nhân được điều trị và có thể đánh giá hiệu quả (217 bệnh nhân dùng EYLEA) trong hai nghiên cứu COPERNICUS và GALILEO. Trong cả hai nghiên cứu, bệnh nhân được phân ngẫu nhiên theo tỉ lệ 3: 2 vào hoặc là nhóm dùng EYLEA 2 mg mỗi 4 tuần (2Q4) hoặc nhóm chứng dùng mũi tiêm giả mỗi 4 tuần với tổng số 6 mũi tiêm.
Sau 6 tháng tiêm, bệnh nhân được điều trị chỉ khi họ đáp ứng tiêu chuẩn tái điều trị được xác định trước, trừ trường hợp bệnh nhân ở nhóm đối chứng trong nghiên cứu GALILEO tiếp tục dùng thuốc giả (đối chứng đến đối chứng).
Tuổi bệnh nhân dao động 22-89 tuổi với tuổi trung bình là 64.
Trong cả hai nghiên cứu, tiêu chí chính đánh giá hiệu quả là tỷ lệ bệnh nhân đạt được ít nhất 15 chữ cái trong đo BCVA ở tuần 24 so với trước điều trị.
Thay đổi về thị lực ở tuần 24 so với trước điều trị là một biến số hiệu quả thứ cấp trong cả hai nghiên cứu COPERNICUS và GALILEO.
Sự khác biệt giữa các nhóm điều trị là có ý nghĩa thống kê, tốt hơn ở nhóm EYLEA trong cả hai nghiên cứu. Trong cả hai nghiên cứu then chốt, sự cải thiện tối đa về thị lực đạt được vào tháng 3 với hiệu quả trên thị lực và độ dày võng mạc trung tâm tiếp tục ổn định cho đến tháng 6. Sự khác biệt có ý nghĩa thống kê được duy trì qua đến tuần 52. Sự khác biệt được duy trì qua đến tuần 76/100.
Kết quả chi tiết từ các phân tích của cả hai nghiên cứu được trình bày trong Bảng và Hình dưới đây.
Bảng 8: Các kết quả về hiệu quả điều trị ở tuần 24, tuần 52 và tuần 76/100 (toàn bộ quần thể nghiên cứu [Full Analysis Set] với LOCFC)) trong các nghiên cứu COPERNICUS và GALILEO
|
Hiệu quả điều trị |
COPERNICUS |
|||||
|
24 tuần |
52 tuần |
100 tuần |
||||
|
EYLEA 2 mg Q4 (N = 114) |
Nhóm chứng (N= 73) |
EYLEA 2 mg (N = 114) |
Nhóm chứngE) (N = 73) |
EYLEA F) 2 mg (N = 114) |
Nhóm chứng E,F) (N = 73) |
|
|
Tỷ lệ bệnh nhân tăng thêm ít nhất 15 chữ cái trong BCVAC) so với trước điều trị |
56% |
12% |
55% |
30% |
49,1% |
23,3% |
|
Sự khác biệt tương đối A,B,E,F) (khoảng tin cậy 95%) |
44,8% (33,0, 56,6) |
|
25,9% (11,8, 40,1) |
|
26,7% (13,1, 40,3) |
|
|
Giá trị p |
p < 0,0001 |
p = 0,0006 |
p=0,0003 |
|||
|
Sự thay đổi trung bình về BCVA được đo bởi điểm chữ cái ETDRSC) so với trước điều trị (SD) |
17,3 (12,8) |
-4,0 (18,0) |
16,2 (17,4) |
3,8 (17,1) |
13,0 (17,7) |
1,5 (17,7) |
|
Sự khác biệt về trung bìnhA,C,D,E,F) (khoảng tin cậy 95%) |
21,7 (17,4, 26,0) |
|
12,7 (7,7, 17,7) |
|
11,8 (6,7, 17,0) |
|
|
Giá trị p |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
|||
|
Hiệu quả điều trị |
GALILEO |
|||||
|
24 tuần |
52 tuần |
76 tuần |
||||
|
EYLEA 2 mg Q4 (N = 103) |
Nhóm chứng (N = 68) |
EYLEA 2 mg (N = 103) |
Nhóm chứng (N = 68) |
EYLEA G) 2 mg (N = 103) |
Nhóm chứng G) (N = 68) |
|
|
Tỷ lệ bệnh nhân tăng thêm ít nhất 15 chữ cái trong BCVAC) so với trước điều trị |
60% |
22% |
60% |
32% |
57,3% |
29,4% |
|
Sự khác biệt tương đối A,B,G) (Khoảng tin cậy 95%) |
38,3% (24,4, 52,1) |
|
27,9% (13,0, 42,7) |
|
28,0% (13,3, 42,6) |
|
|
Giá trị p |
p < 0,0001 |
p = 0,0004 |
p=0,0004 |
|||
|
Sự thay đổi trung bình về BCVA được đo bởi điểm chữ cái ETDRSC) so với trước điều trị (SD) |
18,0 (12,2) |
3,3 (14,1) |
16,9 (14,8) |
3,8 (18,1) |
13,7 (17,8) |
6,2 (17,7) |
|
Hiệu quả điều trị |
GALILEO |
|||||
|
24 tuần |
52 tuần |
76 tuần |
||||
|
EYLEA 2 mg Q4 (N = 103) |
Nhóm chứng (N = 68) |
EYLEA 2 mg (N = 103) |
Nhóm chứng (N = 68) |
EYLEA G) 2 mg (N = 103) |
Nhóm chứng G) (N = 68) |
|
|
Sự khác biệt về trung bình LS A,C,D,G) (khoảng tin cậy 95%) |
14,7 (10,8, 18,7) |
|
13,2 (8,2, 18,2) |
|
7,6 (2,1, 13,1) |
|
|
giá trị p |
p < 0,0001 |
p < 0,0001 |
p=0,0070 |
|||
A) Sự khác biệt được tính là kết quả nhóm EYLEA 2 mg mỗi 4 tuần trừ kết quả của nhóm chứng
B) Sự khác biệt và khoảng tin cậy (CI) được tính bằng cách sử dụng kiểm định Cochran-Mantel-Haenszel (CMH) hiệu chỉnh cho khu vực (Mỹ so với phần còn lại của thế giới trong nghiên cứu COPERNICUS và Châu Âu so với Châu Á/Thái Bình Dương trong nghiên cứu GALILEO) và phân loại BCVA trước điều trị (> 20/200 và ≤20/200)
C) BCVA (Best Corrected Visual Acuity): Thị lực tốt nhất sau chỉnh kính
ETDRS (Early Treatment Diabetic Retinopathy Study): Nghiên cứu điều trị sớm bệnh lý võng mạc do đái tháo đường
LOCF (Last Observation Carried Forward): Phương pháp lấy kết quả lần đo cuối cùng thay thế cho dữ liệu bị mất
SD (Standard deviation): độ lệch chuẩn
LS: Giá trị trung bình (phương pháp bình phương tối thiểu) xác định từ phân tích ANCOVA
D) Sự khác biệt trung bình LS và khoảng tin cậy dựa trên một mô hình ANCOVA với các yếu tố là nhóm điều trị, khu vực (Mỹ so với phần còn lại của thế giới trong nghiên cứu COPERNICUS và Châu Âu so với Châu Á/Thái Bình Dương trong nghiên cứu GALILEO) và phân loại BCVA trước điều trị (> 20/200 và ≤ 20/200)
E) Trong nghiên cứu COPERNICUS, các bệnh nhân nhóm chứng có thể được dùng EYLEA trên cơ sở nếu thấy cần thiết với tần suất có thể thường xuyên mỗi 4 tuần trong khoảng từ tuần 24 đến tuần 52; bệnh nhân được thăm khám mỗi 4 tuần
F) Trong nghiên cứu COPERNICUS, các bệnh nhân ở cả nhóm chứng và nhóm EYLEA 2mg được sử dụng EYLEA 2 mg trên cơ sở nếu thấy cần thiết với tần suất có thể thường xuyên mỗi 4 tuần bắt đầu từ tuần 52 đến tuần 96; bệnh nhân có lịch thăm khám bắt buộc mỗi quý nhưng có thể được thăm khám thường xuyên hơn, mỗi 4 tuần, nếu cần thiết
G) Trong nghiên cứu GALILEO, các bệnh nhân cả hai nhóm chứng và nhóm EYLEA 2mg được sử dụng EYLEA 2 mg trên cơ sở nếu thấy cần thiết mỗi 8 tuần bắt đầu từ tuần 52 đến tuần 68; bệnh nhân đã có lịch thăm khám bắt buộc mỗi 8 tuần
Hình 2: Thay đổi trung bình về thị lực từ lúc bắt đầu điều trị đến tuần 76/100 của các nhóm điều trị trong các nghiên cứu COPERNICUS và GALILEO (toàn bộ quần thể nghiên cứu - Full Analysis Set, LOCF)


Tỷ lệ bệnh nhân được tưới máu ở nhóm EYLEA trước điều trị là 67,5% (n = 77) trong nghiên cứu COPERNICUS và 86,4% (n = 89) trong nghiên cứu GALILEO. Trong cả 2 nghiên cứu, tỷ lệ bệnh nhân được tưới máu được duy trì hoặc tăng lên qua đến tuần 76/100.
Các hiệu quả có lợi của việc điều trị EYLEA về chức năng thị giác tương tự nhau ở các phân nhóm bệnh nhân được tưới máu và không được tưới máu trước điều trị.
Trong phân tích dữ liệu kết hợp của các nghiên cứu COPERNICUS và GALILEO, EYLEA đã chứng minh sự thay đổi có ý nghĩa lâm sàng so với ban đầu về các tiêu chí đánh giá hiệu quả thứ cấp được xác định trước trên bộ câu hỏi về chức năng thị lực của Viện Mắt Quốc gia (National Eye Institute Visual Function Questionnaire - NEI VFQ-25). Độ lớn của những thay đổi này là tương tự như đã thấy trong các nghiên cứu được xuất bản, tương ứng với mức tăng 15 chữ trong phép đo thị lực tốt nhất sau chỉnh kính (BCVA).
Hiệu quả điều trị trong tất cả các phân nhóm đánh giá được (ví dụ độ tuổi, giới tính, chủng tộc, thị lực trước điều trị, tình trạng tưới máu võng mạc, thời gian bị CRVO) trong mỗi nghiên cứu nói chung là phù hợp với các kết quả trong các quần thể chung.
Bệnh nhân người cao tuổi
Trong các nghiên cứu CRVO, khoảng 52% (112/217) bệnh nhân được phân ngẫu nhiên để điều trị với EYLEA là từ 65 tuổi trở lên và khoảng 18% (38/217) là từ 75 tuổi trở lên.
Phù hoàng điểm thứ phát do tắc nghẽn nhánh tĩnh mạch võng mạc (BRVO)
An toàn và hiệu quả của EYLEA được đánh giá trong một nghiên cứu đa trung tâm, ngẫu nhiên, mù đôi, có so sánh với đối chứng có tác dụng điều trị ở những bệnh nhân có phù hoàng điểm thứ phát với BRVO trong đó bao gồm tắc nhánh tĩnh mạch võng mạc trung tâm (Hemi-Retinal Vein Occlusion). Tổng cộng có 181 bệnh nhân được điều trị và có thể đánh giá được về hiệu quả (91 ở nhóm EYLEA) trong nghiên cứu VIBRANT. Trong nghiên cứu, các bệnh nhân được chọn ngẫu nhiên theo tỉ lệ 1:1 vào nhóm dùng hoặc là 2 mg EYLEA mỗi 4 tuần (2Q4) với tổng cộng 6 mũi tiêm hoặc điều trị quang đông bằng laser dùng lúc ban đầu và tiếp tục sau đó nếu cần thiết (nhóm đối chứng laser). Các bệnh nhân trong nhóm đối chứng laser có thể được điều trị thêm quang đông bằng laser (gọi là "điều trị laser giải cứu") bắt đầu vào tuần 12, nếu đáp ứng ít nhất một tiêu chí điều trị giải cứu được xác định trước. Khoảng thời gian tối thiểu giữa các lần điều trị quang đông bằng laser là 12 tuần. Sau 24 tuần, bệnh nhân trong nhóm EYLEA được dùng 2 mg mỗi 8 tuần qua đến tuần 48, và bệnh nhân trong nhóm chứng có thể được điều trị bằng EYLEA 2mg, nếu đáp ứng ít nhất một tiêu chí giải cứu được xác định trước. Điều trị giải cứu bằng EYLEA bao gồm một chế độ liều cố định với 2mg EYLEA dùng mỗi 4 tuần (2Q4) trong 3 lần và sau đó tiêm trong dịch kính mỗi 8 tuần qua đến tuần 48.
Lứa tuổi bệnh nhân dao động từ 42 đến 94 với tuổi trung bình là 65.
Trong nghiên cứu VIBRANT, tiêu chí đánh giá hiệu quả chính là tỷ lệ bệnh nhân tăng được ít nhất 15 ký tự trong BCVA ở tuần 24 so với trước điều trị. Ở tuần 24, nhóm điều trị EYLEA đã vượt trội so với nhóm chứng laser về kết quả điều trị chính.
Thay đổi về thị lực ở tuần 24 so với trước điều trị là một biến số hiệu quả thứ cấp trong nghiên cứu VIBRANT. Sự khác biệt giữa các nhóm điều trị là có ý nghĩa thống kê tốt hơn ở nhóm EYLEA. Quá trình cải thiện thị giác là nhanh chóng và cải thiện tối đa đạt được ở tuần 12 và tiếp tục có hiệu quả ổn định về thị lực và độ dày võng mạc trung tâm cho đến tuần 24.
Kết quả về thị lực và giải phẫu được duy trì khi dùng EYLEA 2 mg mỗi 8 tuần, bắt đầu từ tuần 24 ở nhóm điều trị EYLEA.
Trong nhóm điều trị laser, 67 bệnh nhân được điều trị giải cứu với EYLEA bắt đầu vào tuần 24. Trong nhóm điều trị này thị lực được cải thiện ở mức khoảng 5 chữ cái từ tuần 24 đến 52. Các kết quả chi tiết từ việc phân tích nghiên cứu VIBRANT được thể hiện trong Bảng và Hình dưới đây.
Bảng 9: Các kết quả về hiệu quả điều trị ở tuần 24 và ở tuần 52 (Toàn bộ quần thể nghiên cứu [Full Analysis Set] với LOCF) trong nghiên cứu VIBRANT.
|
Hiệu quả điều trị |
VIBRANT |
|||
|
24 tuần |
52 tuần |
|||
|
EYLEA 2mg Q4 (N = 91) |
Nhóm chứng có điều trị (laser) (N = 90) |
EYLEA 2mg Q8 (N=91)D) |
Nhóm chứng có điều trịE) (N = 90) |
|
|
Tỷ lệ bệnh nhân tăng thêm ít nhất 15 chữ cái trong BCVA so với trước điều trị |
52,7% |
26,7% |
57,1% |
41,1% |
|
Sự khác biệt tương |
26,6% |
|
16,2% |
|
|
đốiA,B) (%) |
(13,0, 40,1) |
(2,0, 30,5) |
||
|
(khoảng tin cậy 95% ) |
p=0,0003 |
p = 0,0296 |
||
|
Giá trị p |
|
|
||
|
Sự thay đổi trung bình về BCVA được đo bởi điểm chữ cái ETDRS so với trước điều trị (SD) |
17,0 (11,9) |
6,9 (12,9) |
17,1 (13,1) |
12,2 (11,9) |
|
Sự khác biệt về trung |
10,5 |
|
5,2 |
|
|
bình LS A,C) |
(7,1, 14,0) |
(1,7, 8,7) |
||
|
(khoảng tin cậy 95%) |
p<0,0001 |
p = 0,0035 |
||
|
Giá trị p |
|
|
||
A) Sự khác biệt được tính là kết quả nhóm EYLEA 2 mg Q4 trừ nhóm chứng Laser
B) Sự khác biệt và khoảng tin cậy 95% được tính bằng cách sử dụng mô hình Mantel-Haenszel hiệu chỉnh cho khu vực (Bắc Mỹ so với Nhật Bản) và phân loại BCVA trước điều trị (> 20/200 và ≤20/200)
C) Sự khác biệt trung bình LS và khoảng tin cậy 95% được tính dựa trên một mô hình phân tích ANCOVA với nhóm điều trị, phân loại BCVA trước điều trị (> 20/200 và ≤20/200) và khu vực (Bắc Mỹ so với Nhật Bản) là yếu tố ảnh hưởng cố định và BCVA trước điều trị là đồng biến số.
D) Từ tuần 24, khoảng thời gian giữa hai lần tiêm thuốc ở nhóm điều trị EYLEA đã được nới rộng cho tất cả các đối tượng từ 4 tuần lên 8 tuần, qua đến tuần 48.
E) Bắt đầu từ tuần 24 các đối tượng trong nhóm Laser có thể được điều trị giải cứu với EYLEA, nếu họ đáp ứng ít nhất một tiêu chí lựa chọn xác định trước. Tổng cộng 67 đối tượng trong nhóm này được điều trị giải cứu với EYLEA. Phác đồ cố định cho EYLEA giải cứu là ba lần tiêm EYLEA 2mg mỗi 4 tuần tiếp theo là tiêm mỗi 8 tuần.
Hình 3: Sự thay đổi trung bình BCVA được đo bởi điểm chữ cái ETDRS từ trước điều trị đến tuần 52 trong nghiên cứu VIBRANT (Toàn bộ quần thể nghiên cứu [Full Analysis Set], LOCF)
Tỷ lệ bệnh nhân được tưới máu ở nhóm EYLEA trước điều trị là 60,4% (n = 55). Ở tuần 24 tỷ lệ này tăng lên đến 80,2% (n = 65) và được duy trì ở tuần 52 (77,9%; n = 67).
Lúc đầu, tỷ lệ bệnh nhân được tưới máu ở nhóm bắt đầu điều trị với quang đông bằng laser lưới là 68,9% (n = 62). Tưới máu tại tuần 24 lúc đánh giá tiêu chí hiệu quả chính ở nhóm laser là 67,1% (n = 55). Bệnh nhân trong nhóm laser được phép điều trị giải cứu với EYLEA bắt đầu vào tuần 24 theo tiêu chí xác định trước. Ở tuần 52, 78,0% (n = 64) đã được tưới máu vào thời điểm này.
Các tác dụng có lợi của điều trị EYLEA về chức năng thị giác tương tự nhau ở các nhóm với các bệnh nhân được tưới máu và không được tưới máu trước khi điều trị.
Hiệu quả điều trị trong các phân nhóm đánh giá được (ví dụ, tuổi, giới tính và tình trạng tưới máu võng mạc trước điều trị) trong nghiên cứu, nói chung, phù hợp với các kết quả trong các quần thể chung.
Bệnh nhân lão khoa
Trong nghiên cứu BRVO, khoảng 58% (53/91) bệnh nhân được phân ngẫu nhiên để điều trị với EYLEA là từ 65 tuổi trở lên và khoảng 23% (21/91) là từ 75 tuổi trở lên.
Phù hoàng điểm do đái tháo đường (DME)
An toàn và hiệu quả của EYLEA được đánh giá trong hai nghiên cứu ngẫu nhiên, đa trung tâm, mù đôi có đối chứng với biện pháp có tác dụng điều trị ở những bệnh nhân bị DME. Tổng cộng có 862 bệnh nhân đã được phân ngẫu nhiên và điều trị là có thể đánh giá được về hiệu quả. Trong số đó, 576 được phân ngẫu nhiên vào nhóm EYLEA trong hai nghiên cứu (VIVIDDME và VISTADME). Trong mỗi nghiên cứu, bệnh nhân được phân ngẫu nhiên theo tỉ lệ 1:1:1 vào 1 trong 3 chế độ liều:
- EYLEA dùng 2 mg mỗi 8 tuần sau 5 mũi tiêm hàng tháng ban đầu (EYLEA 2Q8);
- EYLEA dùng 2 mg mỗi 4 tuần (EYLEA 2Q4); và
- Quang đông bằng laser điểm vàng (nhóm chứng có tác dụng điều trị).
Bắt đầu từ tuần 24, các bệnh nhân đáp ứng một ngưỡng xác định trước về tình trạng mất thị lực được thu nhận để nhận thêm điều trị: bệnh nhân trong nhóm EYLEA có thể điều trị laser và các bệnh nhân ở nhóm laser có thể được dùng EYLEA.
Tuổi bệnh nhân dao động từ 23-87 tuổi với tuổi trung bình là 63 tuổi.
Trong cả hai nghiên cứu, tiêu chí đánh giá hiệu quả chính là sự thay đổi trung bình BCVA ở tuần 52 so với trước điều trị được đo bằng điểm chữ cái ETDRS. Cả hai nhóm EYLEA 2Q8 và EYLEA 2Q4 đã cho thấy có hiệu quả vượt trội có ý nghĩa thống kê so với nhóm đối chứng laser.
Lợi ích này được duy trì qua tuần 100.
Kết quả chi tiết từ phân tích các nghiên cứu VIVIDDME và VISTADME được thể hiện trong Bảng và Hình dưới đây.
Bảng 10: Các kết quả về hiệu quả điều trị ở tuần 52 và tuần 100 (Toàn bộ quần thể nghiên cứu [Full Analysis Set] với LOCF) trong nghiên cứu VIVIDDME
|
Hiệu quả điều trị |
VIVIDDME |
VIVIDDME |
||||
|
52 tuần |
100 tuần |
|||||
|
EYLEA 2 mg Q8 A (N = 135) |
EYLEA 2 mg Q4 (N = 136) |
Nhóm chứng có điều trị (laser) (N = 132) |
EYLEA 2 mg Q8 A) (N =135) |
EYLEA 2 mg Q4 (N =136) |
Nhóm chứng có điều trị (laser) (N = 132) |
|
|
Sự thay đổi trung |
|
|
|
|
|
|
|
bình về BCVA được |
|
|
|
|
|
|
|
đo bởi điểm chữ cái |
10,7 |
10,5 |
1,2 |
9,4 |
11,4 |
0.7 |
|
ETDRS E) so với trước điều trị (SD) |
(9,32) |
(9,55) |
(10,65) |
(10,53) |
(11,21) |
(11.77) |
|
Sự khác biệt về |
|
|
|
|
|
|
|
giá trị trung bình LS |
9,1 |
9,3 |
8,2 |
10,7 |
||
|
B,C, E) |
|
|
|
|
||
|
(khoảng tin cậy |
(6,3, 11,8) |
(6,5, 12,0) |
(5,2, 11,3) |
(7,6, 13,8) |
||
|
97,5%) |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
||
|
giá trị p |
|
|
|
|
||
|
Tỷ lệ bệnh nhân tăng thêm ít nhất 10 chữ cái trong BCVAE) so với trước điều trị |
53,3% |
54,4% |
25,8% |
49,6% |
58,1% |
25,0% |
|
Sự khác biệt đã |
|
|
|
|
|
|
|
hiệu chỉnh D,C,E) |
27,5 |
28,7 |
24,6 |
33,1 |
||
|
(khoảng tin cậy |
(14,6, 40,5) |
(15,8, 41,6) |
(11,9, 37,3) |
(20,3, 45,9) |
||
|
97,5%) |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
||
|
giá trị p |
|
|
|
|
||
|
Tỷ lệ bệnh nhân tăng thêm ít nhất 15 chữ cái trong BCVA E) so với trước điều trị |
33,3% |
32,4% |
9,1% |
31,1% |
38,2% |
12,1% |
|
Sự khác biệt đã |
|
|
|
|
|
|
|
hiệu chỉnh D,C,E) |
24,2% |
23,3% |
19,0% |
26,1% |
||
|
(khoảng tin cậy |
(13,5, 34,9) |
(12,6, 33,9) |
(8,0, 29,9) |
(14,8, 37,5) |
||
|
97,5%) |
p < 0,0001 |
p < 0,0001 |
p=0,0001 |
p < 0,0001 |
||
|
giá trị p |
|
|
|
|
||
|
Tỷ lệ bệnh nhân có cải thiện >= 2 bậc trên ETDRS DRSSE,F so với trước điều trị |
27,7% |
33,3% |
7,5% |
32,6% |
29,3% |
8,2% |
|
Sự khác biệt đã |
19,3 |
25,8 |
|
24,4 |
20,9 |
|
|
hiệu chỉnh D,C) |
(6,6, 32,1) |
(12,2, 39,4) |
(11,3, 37,4) |
(7,7, 34,2) |
||
|
(khoảng tin cậy 97,5%) giá trị p |
p = 0,0006 |
p < 0,0001 |
|
p<0.0001 |
p=0,0004 |
|
|
Xem Bảng 4 về sự thay đổi trung bình về CRT so với trước điều trị |
||||||
|
Thay đổi trung bình về NEI VFQ-25 E) phân nhóm các hoạt động gần so với trước điều trị |
5,29 (19,058) |
5,73 (18,932) |
3,54 (16,768) |
6,97 (19,280) |
8,17 (20,193) |
4,8 (15,433) |
|
Sự khác biệt về trung bình LS B, C, E) (khoảng tin cậy 97,5%) giá trị p |
-1,21 (-5,79, 3,37) p = 0,5537 |
2,41 (-2,01, 6,82) p = 0,2208 |
|
-0,74 (-5,25, 3,78) p = 0,7144 |
3,64 (-0,70, 7,98) p = 0,0596 |
|
|
Thay đổi trung bình về NEI VFQ-25 E) phân nhóm các hoạt động xa so với trước điều trị |
5,32 (18,475) |
0,94 (16,487) |
2,26 (15,923) |
4,94 (20,253) |
4,62 (17,618) |
2,2 (16,684) |
|
Sự khác biệt về giá trị trung bình LS B, C, E) (khoảng tin cậy 97,5%) giá trị p |
-0,37 (-4,79, 4,05) p = 0,8498 |
-1,19 (-5,29, 2,91) p = 0,5138 |
|
-1,30 (-6,00, 3,39) p = 0,5325 |
2,57 (-1,73, 6,86) p = 0,1792 |
|
A) Sau khi bắt đầu điều trị với 5 mũi tiêm hàng tháng
B) Trung bình LS và khoảng tin cậy được tính dựa trên mô hình ANCOVA với giá trị đo BCVA trước điều trị là một đồng biến số và một yếu tố là nhóm điều trị. Ngoài ra, khu vực (Châu Âu/ Úc so với Nhật Bản) đã được đưa vào như là một yếu tố đối với VIVIDDME và tiền sử MI và/hoặc CVA là yếu tố trong VISTADME.
C) Sự khác biệt là giá trị của nhóm EYLEA trừ giá trị của nhóm chứng có tác dụng điều trị (laser)
D) Sự khác biệt với khoảng tin cậy (CI) và kiểm định thống kê được tính toán bằng cách sử dụng mô hình
Mantel-Haenszel hiệu chỉnh theo vùng (Châu Âu/ Úc so với Nhật Bản) trong VIVIDDME và tiền sử bị MI hoặc CVA trong VISTADME
E) BCVA (Best Corrected Visual Acuity): Thị lực tốt nhất sau chỉnh kính
ETDRS (Early Treatment Diabetic Retinopathy Study): Nghiên cứu Điều trị sớm Bệnh lý võng mạc do đái tháo đường
LOCF (Last Observation Carried Forward): Phương pháp lấy kết quả của lần đo cuối cùng thay thế các giá trị bị mất
SD (Standard deviation): độ lệch chuẩn
LS (Least square means derived from ANCOVA): Phương pháp bình phương tối thiểu đươc rút ra từ phân tích ANCOVA
DRSS (Diabetic Retinopathy Severity Scale): Thang phân loại mức độ nặng bệnh lý võng mạc do đái tháo đường
CI: Khoảng tin cậy
NEI VFQ-25 (National Eye Institute Visual Function Questionnaire): Bộ câu hỏi đánh giá chức năng thị giác của Viện Mắt Quốc Gia
F) VIVIDDME: dựa trên các bệnh nhân với những hình ảnh có thể phân loại lúc ban đầu và sau khi bắt đầu điều trị (tuần 52, n = 83 (EYLEA 2mg Q8), n = 81 (EYLEA 2mg Q4), n = 80 (laser); tuần 100: n = 86 (EYLEA 2mg Q8), n = 82 (EYLEA 2mg Q4), n = 85 (laser))
Bảng 11: Các kết quả về hiệu quả điều trị ở tuần 52 và tuần 100 (Toàn bộ quần thể nghiên cứu [Full Analysis Set] và LOCF) trong nghiên cứu VISTADME
|
Hiệu quả điều trị |
VISTADME |
VISTADME |
||||
|
52 tuần |
100 tuần |
|||||
|
EYLEA 2 mg Q8 A) (N = 151) |
EYLEA 2 mg Q4 (N = 154) |
Nhóm chứng có điều trị (laser) (N = 154) |
EYLEA 2 mg Q8 A) (N = 151) |
EYLEA 2 mg Q4 (N = 154) |
Nhóm chứng có điều trị (laser) (N = 154) |
|
|
Sự thay đổi trung bình về BCVA được đo bởi điểm chữ cái ETDRS E) so với trước điều trị (SD) |
10,7 (8,21) |
12,5 (9,54) |
0,2 (12,53) |
11,1 (10,70) |
11,5 (13,75) |
0,9 (13,94) |
|
Sự khác biệt về giá trị trung bình LS B,C, E)
(khoảng tin cậy 97,%) giá trị p |
10,45 (7,73, 13,17) p < 0,0001 |
12,19 (9,35, 15,04) p < 0,0001 |
|
10,14 (6,96, 13,32) p < 0,0001 |
10,64 (7,09, 14,18) p < 0,0001 |
|
|
Tỷ lệ bệnh nhân tăng thêm ít nhất 10 chữ cái trong BCVAE) so với trước điều trị |
58,3% |
64,9% |
19,5% |
59,6% |
63,6% |
27,9% |
|
Sự khác biệt đã hiệu chỉnh D,C,E) (khoảng tin cậy 97,5%) giá trị p |
38,8 (27,2, 50,3) p < 0,0001 |
45,9 (34,7, 57,0) p < 0,0001 |
|
31,6 (19,5, 43,7) p < 0,0001 |
36,2 (24,3, 48,1) p < 0,0001 |
|
|
Tỷ lệ bệnh nhân tăng thêm ít nhất 15 chữ cái trong BCVA E) so với trước điều trị |
31,1 |
41,6 |
7,8 |
33,1 |
38,3 |
13,0 |
|
Sự khác biệt đã hiệu chỉnh D,C,E) (khoảng tin cậy 97,5%) giá trị p |
23,3 (13,5, 33,1) p < 0,0001 |
34,2 (24,1, 44,4) p < 0,0001 |
|
20,1 (9,6, 30,6) p < 0,0001 |
25,8 (15,1, 36,6) p < 0,0001 |
|
|
Tỷ lệ bệnh nhân có cải thiện >= 2 bậc trên ETDRS DRSSE so với trước điều trị |
29,1 |
33,8 |
14,3 |
37,1 |
37,0 |
15,6 |
|
Sự khác biệt đã hiệu chỉnh D,C) (khoảng tin cậy 97,5%) giá trị p |
14,9 (4,4, 25,4) p = 0,0017 |
19,7 (9,0, 30,4) p < 0,0001 |
|
21,5 (10,4, 32,5) p = 0,0001 |
21,7 (10,8, 32,6) p < 0,0001 |
|
|
Xem Bảng 5 về sự thay đổi trung bình về CRT so với trước điều trị |
||||||
|
Thay đổi trung bình về NEI VFQ-25 E) phân nhóm các hoạt động gần so với trước điều trị |
9,4 (18,50) |
9,0 (20,60) |
5,4 (20,44) |
12,8 (21,36) |
10,9 (23,12) |
8,1 (22,10) |
|
Sự khác biệt về |
4,36 |
5,19 |
|
5,05 |
4,59 |
|
|
trung bình LS B, C, E) (khoảng tin cậy 97,5%) giá trị p |
(-0,21, 8,93) p = 0,0323 |
(0,33, 10,04) p = 0,0168 |
|
(0,12, 9,98) p = 0,0218 |
(-0,73, 9,90) p = 0,0529 |
|
|
Thay đổi trung bình về NEI VFQ-25 E) phân nhóm các hoạt động xa so với trước điều trị |
7,3 (19,32) |
8,6 (20,99) |
6,7 (19,85) |
8,5 (20,35) |
10,9 (22,05) |
6,1 (20,42) |
|
Sự khác biệt về giá trị trung bình LS B, C, E) (khoảng tin cậy 97,5%) giá trị p |
1,65 (-2,83, 6,13) p = 0,4067 |
2,86 (-1,82, 7,54) p = 0,1702 |
|
3,57 (-0,96, 8,11) p = 0,0772 |
5,80 (0,97, 10,64) p = 0,0072 |
|
A) Sau khi bắt đầu điều trị với 5 mũi tiêm hàng tháng
C) Sự khác biệt được tính là lấy giá trị của nhóm EYLEA trừ giá trị của nhóm đối chứng có tác dụng điều trị (laser)
D) Sự khác biệt với khoảng tin cậy (CI) và kiểm định thống kê được tính toán bằng cách sử dụng mô hình Mantel- Haenszel điều chỉnh theo vùng (Châu Âu/ Úc so với Nhật Bản) trong VIVIDDME và tiền sử có MI hoặc CVA trong VISTADME
E) BCVA (Best Corrected Visual Acuity): Thị lực tốt nhất sau chỉnh kính
ETDRS (Early Treatment Diabetic Retinopathy Study): Nghiên cứu Điều trị sớm Bệnh lý võng mạc do đái tháo đường
LOCF (Last Observation Carried Forward): Phương pháp lấy kết quả của lần đo cuối cùng thay thế các giá trị bị mất
SD (Standard deviation): độ lệch chuẩn
LS (Least square means derived from ANCOVA): Phương pháp bình phương tối thiểu đươc rút ra từ phân tích ANCOVA
DRSS (Diabetic Retinopathy Severity Scale): Thang phân loại mức độ nặng bệnh lý võng mạc do đái tháo đường CI: Khoảng tin cậy
NEI VFQ-25 (National Eye Institute Visual Function Questionnaire): Bộ câu hỏi đánh giá chức năng thị giác của Viện Mắt Quốc Gia
Hình 4: Sự thay đổi trung bình về BCVA được đo bởi điểm chữ cái ETDRS từ trước điều trị đến tuần 100 ở các nghiên cứu VIVIDDME và VISTADME


Ở tuần 52, 33,3% và 33,8% bệnh nhân nhóm 2Q4, 27,7% và 29,1% bệnh nhân ở nhóm 2Q8, và 7,5% và 14,3% bệnh nhân nhóm đối chứng laser trong hai nghiên cứu VIVIDDME và VISTADME, có một sự cải thiện về mức độ nghiêm trọng của bệnh lý võng mạc do đái tháo đường, được đo bằng một sự cải thiện ≥2 bậc trên thang đo mức độ nặng của bệnh lý võng mạc do đái tháo đường (DRSS). Sự cải thiện này đã được duy trì qua đến tuần 100 (chi tiết xem bảng 11).
Hiệu quả điều trị trong các phân nhóm đánh giá được (ví dụ, tuổi, giới tính, chủng tộc, HbA1c lúc ban đầu, thị lực trước điều trị, điều trị kháng VEGF trước đó) trong mỗi nghiên cứu và trong phân tích dữ liệu kết hợp, nhìn chung phù hợp với các kết quả trong các quần thể chung.
Trong các nghiên cứu VIVIDDME và VISTADME, lần lượt có 36 (8,9%) và 197 (42,9%) bệnh nhân được điều trị kháng VEGF trước đó, với khoảng thời gian ngưng dùng thuốc lớn hơn hoặc bằng 3 tháng để loại trừ hết ảnh hưởng của thuốc. Hiệu quả điều trị ở nhóm bệnh nhân trước đó đã được điều trị bằng thuốc ức chế VEGF trước khi tham gia nghiên cứu cũng tương tự như những gì gặp trên bệnh nhân chưa dùng chất ức chế VEGF trước khi tham gia nghiên cứu.
Bệnh nhân có bệnh ở cả hai mắt được phép điều trị kháng VEGF trong mắt còn lại của họ. Trong nghiên cứu VISTADME, 217 (70,7%) bệnh nhân trong nhóm EYLEA được tiêm EYLEA ở cả hai mắt
cho đến tuần 100; trong nghiên cứu VIVIDDME, 97 (35,8%) bệnh nhân nhóm EYLEA được điều trị một loại thuốc kháng VEGF khác ở mắt còn lại của họ.
Một thử nghiệm so sánh độc lập (DRCR.net Protocol T) sử dụng một phác đồ dựa trên các tiêu chuẩn nghiêm ngặt về tái điều trị dựa trên OCT và thị lực. Trong nhóm điều trị afilbercept (n = 224) ở tuần 52, phác đồ điều trị này có kết quả là những bệnh nhân dùng trung bình 9,2 lần tiêm, tương tự với số lượng liều được dùng ở nhóm EYLEA 2Q8 trong nghiên cứu VIVIDDME và VISTADME, trong khi hiệu quả chung của nhóm điều trị aflibercept trong Protocol T tương tự với nhóm EYLEA 2Q8 trong nghiên cứu VIVIDDME và VISTADME . Về thị lực, số chữ cái trung bình tăng được là 13,3, và có 42% bệnh nhân đạt được ít nhất 15 chữ cái, trong Protocol T. Các thông số an toàn về mắt và toàn thân (bao gồm cả ATE) tương tự như VIVIDDME và VISTADME.
Bệnh nhân người cao tuổi
Trong các nghiên cứu pha III trên bệnh nhân DME, khoảng 47% (268/576) bệnh nhân được phân ngẫu nhiên để điều trị với EYLEA là từ 65 tuổi trở lên, và khoảng 9% (52/576) là từ 75 tuổi trở lên.
Tân mạch hắc mạc do cận thị (CNV cận thị)
An toàn và hiệu quả của EYLEA được đánh giá trong một nghiên cứu ngẫu nhiên, đa trung tâm, mù đôi, có đối chứng với giả điều trị ở những bệnh nhân bị tân mạch hắc mạc do cận thị (CNV cận thị). Tổng số 121 bệnh nhân được điều trị và có thể đánh giá được về hiệu quả (90 bệnh nhân dùng EYLEA). Bệnh nhân được phân ngẫu nhiên theo tỉ lệ 3: 1 vào nhóm dùng một lần liều 2 mg EYLEA khi bắt đầu nghiên cứu (tiêm bổ sung trong trường hợp bệnh vẫn còn hoặc tái phát) hoặc nhóm chứng được tiêm giả. Tổng số, có thể có 6 mũi tiêm cho đến tuần 24, thời điểm đánh giá tiêu chí chính.
Sau 6 tháng đầu tiên, bệnh nhân được phân ngẫu nhiên ban đầu ở nhóm dùng mũi tiêm giả đã đủ điều kiện để nhận liều EYLEA đầu tiên vào tuần 24. Những bệnh nhân ở nhóm điều trị giả ban đầu này kể cả những bệnh nhân được phân ngẫu nhiên vào nhóm được điều trị bằng thuốc tiếp tục đủ điều kiện để tiêm bổ sung trong trường hợp bệnh vẫn còn hoặc tái phát.
Độ tuổi của bệnh nhân dao động từ 27 đến 83 tuổi, với tuổi trung bình là 58 tuổi. Tiêu chí hiệu quả chính là sự thay đổi thị lực ở tuần 24 so với thời điểm ban đầu.
Tiêu chí hiệu quả phụ để khẳng định là tỷ lệ bệnh nhân đạt được ít nhất 15 chữ cái trong BCVA vào tuần 24 so với thời điểm ban đầu.
Sự khác nhau giữa các nhóm điều trị là có ý nghĩa thống kê, tốt hơn ở nhóm EYLEA về các tiêu chí hiệu quả chính và phụ ở tuần 24. Sự khác biệt đối với cả hai tiêu chí được duy trì đến tuần 48.
Các kết quả chi tiết từ các phân tích được trình bày trong Bảng và Hình dưới đây.
Bảng 12: Các kết quả về hiệu quả ở tuần 24 (phân tích chính) và tuần 48 trong nghiên cứu MYRROR (Toàn bộ quần thể nghiên cứu với LOCFA))
|
Các kết quả về hiệu quả |
MYRROR |
|||
|
24 Tuần |
48 Tuần |
|||
|
EYLEA 2mgB) (N = 90) |
Giả điều trị (N = 31) |
EYLEA 2mgC) (N = 90) |
Giả điều trị/ EYLEA 2mgD) (N = 31) |
|
|
Sự thay đổi trung bình về BCVA được đo bằng ETDRS so với ban đầu (SD) E) |
12.1 (8.3) |
-2.0 (9.7) |
13.5 (8.8) |
3.9 (14.3) |
|
Sự khác biệt về trung bình LS F,GH,I) (95% CI) giá trị p |
14.1 (10.8, 17.4) p < 0.0001 |
|
9.5 (5.4, 13.7) p<0.0001 |
|
|
Tỷ lệ bệnh nhân đạt được ít nhất 15 chữ cái trong BCVAE) so với ban đầu |
38.9% |
9.7% |
50.0% |
29.0% |
|
Sự khác biệt đã hiệu chỉnh F,H,J) (95% CI) giá trị p |
29.2% (14.4, 44.0) p = 0.0001 |
|
21.0% (1.9, 40.1) p=0.0308 |
|
A) LOCF- (Last Observation Carried Forward): Phương pháp lấy kết quả của lần đo cuối cùng thay thế các giá trị bị mất
B) EYLEA 2 mg được dùng vào lúc ban đầu và có thể mỗi 4 tuần một lần nếu bệnh vẫn tồn tại hoặc tái phát.
C) EYLEA 2 mg dùng từ tuần 24 đến tuần 44 có khả năng 4 tuần một lần trong trường hợp bệnh vẫn tồn tại hoặc tái phát
D) Bắt buộc tiêm EYLEA 2mg vào tuần 24, sau đó có thể tiêm 4 tuần một lần trong trường hợp bệnh vẫn tồn tại hoặc tái phát đến tuần 44.
E) BCVA: (Best Corrected Visual Acuity): Thị lực tốt nhất sau chỉnh kính
ETDRS: (Early Treatment Diabetic Retinopathy Study): Nghiên cứu Điều trị sớm Bệnh lý võng mạc do đái tháo đường
SD: Độ lệch chuẩn
F) Sự khác biệt được xác định là kết quả ở nhóm EYLEA 2mg trừ đi kết quả ở nhóm giả điều trị tại Tuần 24 và kết quả ở nhóm EYLEA 2mg trừ đi kết quả ở nhóm giả điều trị/ EYLEA 2mg ở Tuần 48.
G) Trung bình LS: Giá trị trung bình tính theo phương pháp bình phương tối thiểu đươc rút ra từ mô hình ANCOVA
H) CI: Khoảng tin cậy
I) Sự khác biệt trung bình LS và CI 95% được xác định dựa trên một mô hình ANCOVA với nhóm điều trị và quốc gia (thiết kế theo quốc gia) là những yếu tố ảnh hưởng cố định và BCVA trước điều trị là đồng biến.
J) Sự khác biệt và 95% CI được tính bằng kiểm định Cochran-Mantel-Haenszel (CMH) được điều chỉnh cho quốc gia (thiết kế theo quốc gia)
Hình 5: Sự thay đổi giá trị trung bình về thị lực tại tuần 48 so với trước điều trị theo nhóm điều trị trong nghiên cứu MYRROR (Toàn bộ quần thể nghiên cứu, LOCF)

Thông tin bổ sung về quần thể bệnh nhân đặc biệt
Bệnh nhân suy thận
Không có nghiên cứu đặc biệt ở những bệnh nhân bị suy thận đã được tiến hành với EYLEA. Phân tích dược động học của bệnh nhân bị AMD thể ướt trong nghiên cứu VIEW2, trong đó 40% có suy thận (24% suy thận nhẹ, 15% suy thận trung bình, và 1% suy thận nặng), cho thấy không có sự khác biệt về nồng độ trong huyết tương của dạng thuốc có hoạt tính sau khi tiêm trong dịch kính mỗi 4 hoặc 8 tuần.
Các kết quả tương tự cũng được thấy ở bệnh nhân bị CRVO trong nghiên cứu GALILEO.
Các kết quả tương tự cũng được thấy ở những bệnh nhân bị DME trong nghiên cứu VIVIDDME
Các kết quả tương tự cũng được thấy ở những bệnh nhân bị CNV cận thị trong nghiên cứu MYRROR.
Bệnh nhân suy gan
Không có nghiên cứu đặc biệt hoặc chính thức nào được tiến hành với EYLEA ở những bệnh nhân bị suy gan.
Dữ liệu an toàn tiền lâm sàng
Trong các nghiên cứu tiền lâm sàng về độc tính liều lặp lại, các tác dụng chỉ được ghi nhận ở các mức độ phơi nhiễm toàn thân, mà khi xem xét về mặt bản chất, vượt quá mức độ phơi nhiễm toàn thân tối đa trên người sau khi dùng đường tiêm trong dịch kính với mức liều dự kiến sử dụng trên lâm sàng, chỉ ra sự ít phù hợp với việc sử dụng trên lâm sàng.
Đã quan sát thấy trợt và loét biểu mô đường hô hấp ở vùng cuốn mũi ở những con khỉ điều trị bằng aflibercept tiêm trong dịch kính với mức tiếp xúc toàn thân vượt quá mức tiếp xúc tối đa ở người. Mức tiếp xúc toàn thân dựa trên Cmax và AUC đối với aflibercept dạng tự do lần lượt cao hơn khoảng 200 và 700 lần, khi so sánh với các giá trị quan sát thấy ở người sau khi tiêm trong dịch kính một liều 2 mg. Ở mức liều không quan sát thấy phản ứng có hại (No Observed Adverse Effect Level -NOAEL) là 0,5 mg/mắt ở khỉ, mức tiếp xúc toàn thân dựa trên Cmax và AUC cao hơn lần lượt là 42 và 56 lần.
Chưa thực hiện các nghiên cứu về khả năng gây ung thư và gây đột biến của aflibercept.
Aflibercept có tác dụng trên sự phát triển trong tử cung trong một nghiên cứu trên sự phát triển của phôi –thai ở thỏ mang thai dùng thuốc theo đường tiêm tĩnh mạch (liều từ 3-60 mg/kg) cũng như tiêm dưới da (mức liều từ 0,1 đến 1 mg/kg). Mức liều không quan sát thấy phản ứng có hại (NOAEL) trên mẹ lần lượt là mức liều 3 mg/kg hoặc 1 mg/kg, Chưa xác định được NOAEL trên sự phát triển của phôi thai. Ở mức liều 0,1 mg/kg, mức độ phơi nhiễm toàn thân dựa trên Cmax và AUC của aflibercept dạng tự do cao hơn lần lượt khoảng 17 và 10 lần, khi so sánh với các giá trị tương ứng ở người khi tiêm trong dịch kính với liều 2 mg.
Các tác dụng trên khả năng sinh sản ở nam giới và nữ giới được đánh giá như là một phần của một nghiên cứu kéo dài 6 tháng trên khỉ được tiêm tĩnh mạch aflibercept với các mức liều trong khoảng từ 3-30 mg/kg. Đã quan sát thấy kinh nguyệt không đều hoặc mất kinh có liên quan đến sự thay đổi về nồng độ hormone sinh dục nữ và những thay đổi về hình thái và khả năng di động của tinh trùng ở tất cả các mức liều. Dựa trên Cmax và AUC của aflibercept dạng tự do quan sát ở mức liều 3 mg/kg tiêm tĩnh mạch, mức tiếp xúc toàn thân cao hơn lần lượt là khoảng 4900 lần và 1500 lần, so với các mức tiếp xúc quan sát thấy ở người sau khi tiêm trong dịch kính một liều 2 mg. Tất cả những thay đổi có thể hồi phục.
24 tháng kể từ ngày sản xuất
Bảo quản ở trong tủ lạnh (2°C đến 8°C/ 36°F đến 46 °F).
Không làm đông lạnh.
Giữ lọ thuốc trong hộp bao bì ngoài bằng carton để tránh ánh sáng.
Lọ thuốc:
Mỗi hộp carton bao gồm một lọ thủy tinh loại I chứa thể tích 278 microlit dung dịch tiêm trong dịch kính với một nút cao su nhựa dẻo và một kim tiêm kèm đầu lọc kích thước 18 G.
Qui cách đóng gói: Hộp gồm 1 lọ chứa 278 µl dung dịch tiêm có thể lấy ra được 100 µl và 1 kim tiêm.
Lọ chỉ dùng cho một lần ở một mắt duy nhất. Việc lấy nhiều liều từ một lọ có thể làm tăng nguy cơ nhiễm bẩn và nhiễm trùng sau đó.
Trước khi sử dụng, kiểm tra dung dịch tiêm bằng mắt thường. Không sử dụng lọ thuốc nếu nhìn thấy các tiểu phân, vẩn đục hoặc đổi màu.
Trước khi sử dụng, lọ thuốc chưa mở có thể bảo quản ở nhiệt độ phòng (25°C/77°F) trong khoảng thời gian lên đến 24 giờ. Sau khi mở lọ thuốc hoặc vỉ thuốc, tiến hành sử dụng thuốc trong điều kiện vô khuẩn.
Để tiêm trong dịch kính, nên sử dụng kim tiêm kích thước 30 G x ½ inch.
Lọ thuốc:
1. Tháo bỏ phần chụp nhựa và sát trùng bên ngoài nắp cao su của lọ thuốc.

2. Gắn kim tiêm loại 18 G có màng lọc với kích thước lỗ lọc 5 micron, vào một bơm tiêm vô trùng 1mL có đầu kiểu Luer-lock.

3. Ấn kim tiêm có màng lọc vào giữa nút lọ cho đến khi kim cắm hoàn toàn vào lọ và đầu kim chạm vào đáy hoặc cạnh của lọ
4. Sử dụng kỹ thuật vô trùng, rút tất cả lượng thuốc trong lọ EYLEA vào bơm tiêm, giữ lọ ở vị trí đứng, hơi nghiêng để dễ rút hết thuốc. Để ngăn ngừa không khí lọt vào, phải đảm bảo góc xiên của kim tiêm có màng lọc ngập trong dung dịch. Tiếp tục nghiêng lọ trong khi rút thuốc trong khi vẫn giữ góc xiên của kim lọc ngập trong dung dịch.

5. Đảm bảo rằng trục pit tông được rút về phía sau đủ nhiều khi rút rỗng lọ thuốc để làm rỗng hoàn toàn kim tiêm có màng lọc. Sau khi tiêm, cần bỏ đi những phần thuốc không sử dụng nữa.
6. Tháo kim tiêm có màng lọc ra và loại bỏ nó theo đúng quy định.
Lưu ý: Kim tiêm có màng lọc không được sử dụng để tiêm trong dịch kính.
7. Sử dụng kỹ thuật vô trùng, vặn chặt một kim tiêm kích thước 30 G x 1/2 inch vào đầu bơm tiêm kiểu Luer–lock

8. Giữ bơm tiêm với đầu kim tiêm hướng lên trên, kiểm tra bơm tiêm xem có bóng khí không. Nếu có bóng khí, gõ nhẹ vào bơm tiêm bằng ngón tay cho đến khi bóng khí đi lên phía trên.
9. Loại tất cả các bóng khí và loại phần thuốc dư bằng cách đẩy chậm pit tông đến khi phần đầu pit tông ngang hàng với vạch đánh dấu 0,05ml trên bơm tiêm.


Tiêu chuẩn cơ sở
Tên cơ sở sản xuất (chịu trách nhiệm sản xuất bán thành phẩm)
Regeneron Pharmaceuticals Inc.
Địa chỉ : 81 Columbia Turnpike Rensselaer, New York 12144, Mỹ
Tên cơ sở đóng gói sơ cấp:
Vetter Pharma-Fertigung GmbH & Co.KG
Địa chỉ : Eisenbahnstraβe 2-4, 88085 Langenargen, Đức
Tên cơ sở đóng gói thứ cấp (chịu trách nhiệm kiểm tra chất lượng và xuất xưởng)
Bayer AG
Địa chỉ: Müllerstraβe 178, 13353 Berlin, Đức
Ngày duyệt tờ hướng dẫn sử dụng:
EYLEA/CCDS12/02022018/VN PI01

